Questões Militares
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 115 questões
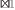 1, na solução resultante é igual a
1, na solução resultante é igual a 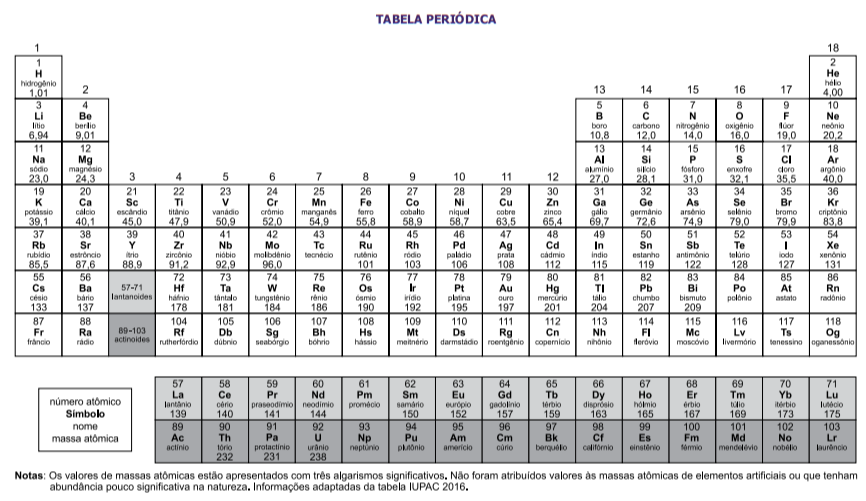
O indicador vermelho de fenol apresenta cor amarela em
soluções aquosas de pH < 6,4, e, cor vermelha, em soluções
aquosas de pH > 8,2. Na água pura (pH = 7,0), esse indicador
apresenta cor laranja.
A uma amostra de água pura foi acrescentado o indicador vermelho de fenol. Em seguida, foi acrescentado certo óxido que mudou a cor apresentada por esse indicador de laranja para amarela. Esse óxido pode ter sido o
Considere as seguintes equações de neutralização.
H2SO4 + 2 NaOH → X + 2 H2O
H2SO4 + NaOH → Y + H2O
As substâncias que correspondem às letras X e Y são, respectivamente:
Um litro de uma solução de HCl com pH = 2 deve ser neutralizada com uma solução de NaOH 1 mol.L-1.
O volume, em mL, da solução básica necessário para realizar essa neutralização é igual a
Em um acidente ocorrido em Ribeirão Preto (SP), um caminhão tombou e provocou o vazamento de 25 litros de ácido nítrico (HNO3). Segundo informações do Corpo de Bombeiros Militar local, um dos compartimentos que transportavam esse produto caiu do caminhão e, ao bater no chão, a tampa se soltou e causou o derramamento do produto. O Corpo de Bombeiros Militar utilizou como reagente neutralizante do produto carbonato de sódio (Na2 CO3 ).
Disponível em: <http://g1.globo.com/sp/ribeirao-preto-franca/noticia/ 2013/11/ caminhao-tomba-e-causa-vazamento-de-acidoem-rodovia-de-ribeirao-preto.html>. Acesso em: out. 2018. [Fragmento adaptado].
Sabe-se que o reagente derramado tem as seguintes características:
1. Densidade igual a 1,5 g/mL.
2. Percentual em massa igual a 60%.
Nessas condições, é correto afirmar que a massa de carbonato de sódio, em quilogramas, que reagiu completamente com o ácido para neutralizá-lo é de, aproximadamente,
A fórmula mínima desse óxido é:

A alternativa que descreve, respectivamente, a correta nomenclatura oficial destes ácidos é:
Considerando que: - a solução básica foi parcialmente neutralizada pela solução do ácido; - o ácido clorídrico é um ácido forte (α=100%); - o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60
Considere as seguintes equações de neutralização total representadas abaixo.
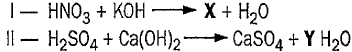
Sobre esses compostos químicos, assinale a alternativa CORRETA.
Analise as reações abaixo.
NH4+ + H2O = NH3 + H3O+
[AI(H2O)4]3+ + H2O = [Al(H2O )3OH]2+ + H3O +
De acordo com a teoria de Brõnsted-Lowry, NH3 e [AI(H2O)4]3+, nas reações acima, são considerados, respectivamente:
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
O KNO₃ é um sal inorgânico resultante da reação de neutralização entre o hidróxido de potássio e o ácido nítrico.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
Os óxidos são substâncias artificiais produzidas pela indústria.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
O principal produto das reações de neutralização é a água.
Dadas as seguintes equações que representam supostas reações químicas irreversíveis em meio aquoso e temperaturas moderadas:
I) 6 HBr + 2 Al → 2 AlBr3 + 3 H2
II) H2SO4 + BaCl2 → BaSO4 + 2 HCl
III) 2 KOH + NiSO4 → Ni(OH)2 + K2SO4
IV) 2 HBr + K2S → 2 KBr + H2S
V) BaCl2 + Na2CO3 → BaCO3 + 2 NaCl
Pode-se afirmar que a reação:
Conversores catalíticos (catalisadores) de automóveis são utilizados para reduzir a emissão de poluentes tóxicos. Poluentes de elevada toxicidade são convertidos a compostos menos tóxicos. Nesses conversores, os gases resultantes da combustão no motor e o ar passam por substâncias catalisadoras. Essas substâncias aceleram, por exemplo, a conversão de monóxido de carbono (CO) em dióxido de carbono (CO2) e a decomposição de óxidos de nitrogênio como o NO, N2O e o NO2 (denominados NOx) em gás nitrogênio (N2) e gás oxigênio (O2). Referente às substâncias citadas no texto e às características de catalisadores, são feitas as seguintes afirmativas:
I - a decomposição catalítica de óxidos de nitrogênio produzindo o gás oxigênio e o gás nitrogênio é classificada como uma reação de oxidorredução;
II - o CO2 é um óxido ácido que, ao reagir com água, forma o ácido carbônico;
III - catalisadores são substâncias que iniciam as reações químicas que seriam impossíveis sem eles, aumentando a velocidade e também a energia de ativação da reação;
IV - o CO é um óxido básico que, ao reagir com água, forma uma base;
V - a molécula do gás carbônico (CO2) apresenta geometria espacial angular.
Das afirmativas feitas estão corretas apenas a
Em ambientes fechados, o superóxido de potássio (KO2) é utilizado em máscaras de respiração, para remover o dióxido de carbono e a água do ar exalado. A remoção de água gera oxigênio para a respiração por meio da reação
4KO2(s) + 2H2O(l) → 3O2(g) + 4KOH(s). (I)
O hidróxido de potássio remove o dióxido de carbono da máscara pela reação
KOH(s) + CO2(g) → KHCO3(s). (II)
P. W. Atkins e L. Jones. Princípios de química. Rio de Janeiro: LTC, 2006, p. 125.
Com base nas informações acima, julgue o próximo item.
A equação II representa a reação entre uma base forte e um
óxido ácido, da qual resulta o sal carbonato de potássio
Em ambientes fechados, o superóxido de potássio (KO2) é utilizado em máscaras de respiração, para remover o dióxido de carbono e a água do ar exalado. A remoção de água gera oxigênio para a respiração por meio da reação
4KO2(s) + 2H2O(l) → 3O2(g) + 4KOH(s). (I)
O hidróxido de potássio remove o dióxido de carbono da máscara pela reação
KOH(s) + CO2(g) → KHCO3(s). (II)
P. W. Atkins e L. Jones. Princípios de química. Rio de Janeiro: LTC, 2006, p. 125.
Com base nas informações acima, julgue o próximo item.
A análise da estrutura do superóxido de potássio demonstra
que ele é uma substância de natureza molecular.
Bebidas especialmente ingeridas por esportistas têm representado importante fatia de consumo. Tais bebidas são soluções isotônicas repositoras hidroeletrolíticas e, portanto, auxiliam na manutenção e preparação física de atletas de todas as modalidades. A seguir, reproduz-se parte da tabela nutricional constante no rótulo de uma dessas bebidas.

A partir dessas informações e considerando os múltiplos aspectos que
elas suscitam, julgue o item subsequente.
Os cloretos de sódio e de potássio podem ser preparados por
meio da neutralização total do ácido clórico com hidróxidos de
sódio e de potássio, respectivamente.