Questões Militares
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 170 questões
no início do ano, foi detectada a contaminação do solo, da água e
até de alimentos com isótopos radioativos, como iodo-131 e césio-
137. Sabendo que o iodo-131 emite radiação beta durante a sua
desintegração e tem meia-vida de 8 dias, julgue o seguinte item.

fundido e que, no processo, além do Na(s), também se forma

julgue o item seguinte.
A composição química do cimento Portland, utilizado na construção civil, varia ligeiramente conforme o que está indicado na tabela abaixo:
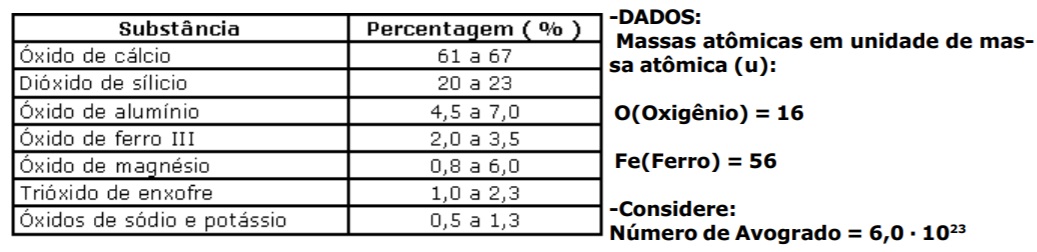
Assinale a alternativa correta:
I- 1s2 2s2 2p6
II- 1s2 2s2 2p6 3s1
III- 1s2 2s2 2p6 3s2
IV- 1s2 2s2 2p6 3s2 3p5
Com base nessas informações, a alternativa correta é:
O raio do íon sódio (Na+) é inferior ao do íon potássio (K+).
Os átomos de um elemento Z cujo número atômico é 20 se unem com os átomos de um elemento Y cujo número atômico é 7 através de uma ligação iônica. Qual a fórmula do composto formado por esses dois elementos?
O estudo da Lei Periódica permite que sejam
estudadas as principais propriedades periódicas
dos elementos químicos.
Dados: A= massa atômica; d= densidade em
g∙cm-3
Considerando a capacidade de predição da
Tabela Periódica e dado o trecho dela, afirma-se
corretamente que a massa atômica e a
densidade mais prováveis do alumínio são,
respectivamente:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
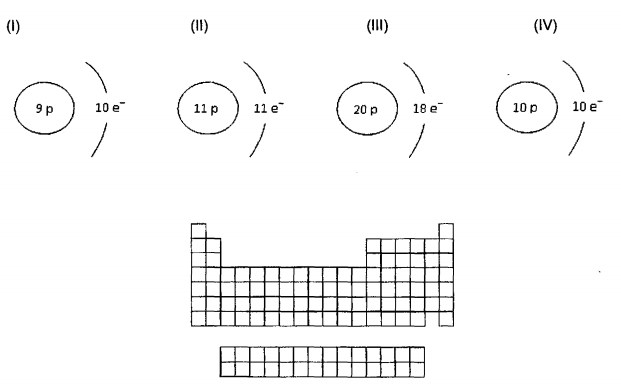
considere as espécies de (I) a (IV) e o arcabouço da Tabela Periódica representados a seguir. Assinale a alternativa correta.
Fonte http: / /noticias.terra.com.br/ciencia/ interna/0, , OI3818860- EI238,00.html (Texto adaptado)
Com base nas informações contidas no texto analise as seguintes proposições e classifique-as com F (falso) ou V (verdadeiro) , assinalando a opção correta.
( ) Este novo elemento químico de número atômico 112 será classificado como um elemento de transição.
( ) O elemento químico de número atômico 112 pertence ao período 7 e à coluna 12 ou 2B da classificação periódica dos elementos.
( ) Considerando ser 277 o número de massa de seu isótopo mais estável, esta espécie apresenta 165 prótons e 112 neutrons em seu núcleo.
( ) A 25°C e pressão de 1 atm, seu estado físico deverá ser gasoso.
Assinale a opção que apresenta a sequencia correta de resultados da classificação das afirmações.
I. A fusão do enxofre elementar,S8(s) produz moléculas S8
II. Sílica, (SiO2)n é um exemplo de sólido molecular.
III. A fusão da sílica, (SiO2)n, ocorre com quebra das ligações Si-O.
IV. Sólidos iônicos são bons condutores de eletricidade.
V. As partículas formadoras dos sólidos metálicos são átomos.
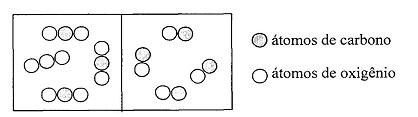
( ) O compartimento da esquerda contém mais elementos que o da direita.
( ) Os compartimentos contêm a mesma massa de carbono.
( ) A proporção de oxigênio para carbono é a mesma em ambos os compartimentos.
( ) As quantidades de matéria de cada gás são as mesmas em cada compartimento.
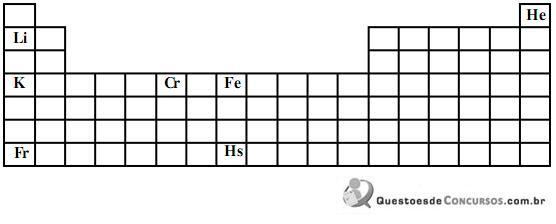
Sobre tais elementos químicos, assinale a alternativa correta.
Observação:
Adote a convenção de que o primeiro elétron a ocupar um orbital possui o número quântico de spin igual a -1/2.
I - O número atômico do ferro (Fe) é 26.
II - O nível/subnível 3d6 contém os elétrons mais energéticos do átomo de ferro (Fe), no estado fundamental.
III - O átomo de ferro (Fe), no nível/subnível 3d6, possui 3 elétrons desemparelhados, no estado fundamental.
IV - O átomo de ferro (Fe) possui 2 elétrons de valência no nível 4 (4s2), no estado fundamental.
Das afirmações feitas, está(ão) correta(s)
