Questões Militares
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 170 questões
São dadas as seguintes afirmativas:
I – Joseph J. Thomson, em seu modelo atômico, descrevia o átomo como uma estrutura na qual a carga positiva permanecia no centro, constituindo o núcleo, enquanto as cargas negativas giravam em torno desse núcleo;
II – um átomo, no estado fundamental, que possui 20 elétrons na sua eletrosfera, ao perder dois elétrons, gerará um cátion bivalente correspondente, com configuração eletrônica – segundo o diagrama de Linus Pauling – igual a 1s2 2s2 2p6 3s2 3p6;
III – a afinidade eletrônica (eletroafinidade) aumenta conforme o raio atômico diminui. Dessa forma, devido ao seu menor raio atômico, o oxigênio (Z=8) possui maior afinidade eletrônica do que o enxofre (Z=16), ambos pertencentes à mesma família da Tabela Periódica;
IV – o raio de um íon negativo (ânion) é sempre menor que o raio do átomo que lhe deu origem.
Das afirmações feitas, utilizando os dados acima, estão corretas apenas:
I. O átomo A deve ter maior energia de ionização que o átomo B.
II. A distância da ligação entre os átomos na molécula A2 deve ser menor do que aquela na molécula B2.
III. A energia de ionização do elétron no orbital 1s do átomo A deve ser maior do que aquela do elétron no orbital 1s do átomo de hidrogênio.IV. A energia de ligação dos átomos na molécula B2 deve ser menor do que aquela dos átomos na molécula de hidrogênio (H2) .
Das afirmações acima está(ão) CORRETA(S) apenas
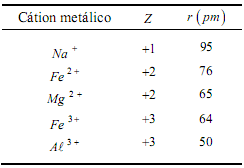
A tabela abaixo apresenta os números de cargas elétricas (Z) e o raio iônico (r) apresentados por alguns cátions metálicos.
Para as mesmas condições de temperatura e pressão é CORRETO afirmar que o pH de soluções aquosas, com concentração 1mol . L−1 dos nitratos de cada um dos cátions apresentados na tabela, aumenta na sequência:
19X39 20Y54 19Z40 17W37
Assinale a opção em que os átomos são isótopos.
Observe a tabela abaixo.

Os valores de Z (N° Atômico), A (N° de Massa), p+ (Prótons), e- (Elétrons) e n° (Nêutrons) do íon Potássio (K) carregado positivamente, na forma catiônica, e com carga elétrica igual a +1, são respectivamente:
Dados: N° estado fundamental o Potássio (K) possui N° Atômico = 19 e N° de Massa = 39.
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
A configuração eletrônica do íon Fe3+, segundo o diagrama de Linus
Pauling, é 1s2
2s2
2p6
3s2
3p6
4s2
3d3
.
Em relação à estrutura atômica, observe as espécies de I a IV, representadas a seguir:
I - 10 prótons, 10 nêutrons, 10 elétrons.
II - 09 prótons, 10 nêutrons, 10 elétrons.
III- 10 prótons, 09 nêutrons, 10 elétrons.
IV - 10 prótons, 10 nêutrons, 11 elétrons.
Assinale a opção cujas espécies apresentam íons.
Assinale a alternativa que completa correta e respectivamente as lacunas da afirmativa a seguir.
Em um átomo em equilíbrio, o número de _________ é igual a(ao) _____________.
Considere as seguintes afirmações a respeito dos haletos de hidrogênio HF HCl HBr e HI :
I. A temperatura de ebulição do HI é maior do que a dos demais. I
I. À exceção do HF ,os haletos de hidrogênio dissociam-se completamente em água.
III. Quando dissolvidos em ácido acético glacial puro, todos se comportam como ácidos, conforme a seguinte ordem de força ácida: HI > HBr > HCl >> HF
Das afirmações acima, está(ão) CORRETA(S) apenas
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
A massa m de um isótopo radioativo que continua ativa em um instante t pode ser determinada pela expressão m = m0e–kt , em que k é a constante de decaimento radioativo, característica do isótopo, e m0, a massa ativa do isótopo no instante t = 0.