Questões Militares de Química - Teoria Atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica
Foram encontradas 171 questões
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
A configuração eletrônica do íon Fe3+, segundo o diagrama de Linus
Pauling, é 1s2
2s2
2p6
3s2
3p6
4s2
3d3
.
É natural buscar a formação de classes ou grupos em função de interesses ou características comuns. Em se tratando de elementos químicos, a busca por agrupamentos com base em determinadas propriedades atômicas resultou no que se conhece hoje como a Tabela Periódica. Como consequência, tornou-se possível sistematizar, por exemplo, o conhecimento relativo às propriedades químicas e físicas dos elementos.
Sobre a propriedade do elemento Rádio (Ra) é correto afirmar que ele é o
Os elementos A, B e C têm as seguintes configurações eletrônicas em suas camadas de valência:
A — 3S1
B — 4s2 4p4
C — 3s2
Com base nessas informações, assinale a opção correta.
Sobre a tabela periódica, analise as afirmativas a seguir.
I. Os elementos químicos estão dispostos em ordem crescente dos números atômicos.
II. As linhas horizontais são as Famílias.
III. As propriedades químicas estão ligadas à distribuição eletrônica do elemento.
IV. Os elementos da Família 3 A são metais.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Moléculas de lítio não existem no estado líquido ou sólido, mas, sem dúvida, as moléculas diatômicas são encontradas no lítio gasoso. A energia de ligação do Li2 é 105 kJ/mol.
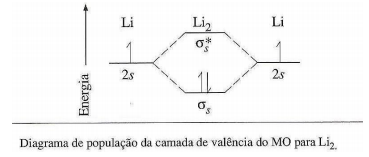
Sobre o diagrama de população da camada de valência do MO para Li2, analise as afirmativas a seguir.
I. A ordem de ligação é 1/2.
II. A configuração eletrônica de Li2 pode ser escrita como KK (σs)2 .
III. A energia de ligação do Li2 é menor do que H2 porque há uma blindagem do núcleo pela camada K completa de cada átomo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
CONSTANTES

DEFINIÇÕES


Considere as seguintes proposições para espécies químicas no estado gasoso:
I. A energia de ionização do íon Be3+ é maior do que a do íon He+ .
II. O momento dipolar elétrico total da molécula de XeF4 é maior do que o da molécula de XeF2.
III. A energia necessária para quebrar a molécula de F2 é maior do que a energia necessária para quebrar a molécula de O2.
IV. A energia do orbital 2s do átomo de berílio é igual à energia do orbital 2s do átomo de boro.
Das proposições acima, está(ão) CORRETA(S)
CONSTANTES

DEFINIÇÕES


Observe as espécies a seguir:
I- 05 prótons, 05 nêutrons e 05 elétrons
lI- 05 prótons, 06 nêutrons e 05 elétrons
III- 06 prótons, 05 nêutrons e 05 elétrons
IV- 05 prótons, 05 nêutrons e 04 elétrons
Assinale a opção cujas espécies representam íons.