Questões Militares
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 170 questões
Munições traçantes são aquelas que possuem um projétil especial, contendo uma carga pirotécnica em sua retaguarda. Essa carga pirotécnica, após o tiro, é ignificada, gerando um traço de luz colorido, permitindo a visualização de tiros noturnos a olho nu. Essa carga pirotécnica é uma mistura química que pode possuir, dentre vários ingredientes, sais cujos íons emitem radiação de cor característica associada ao traço luminoso.
Um tipo de munição traçante usada por um exército possui na sua composição química uma determinada substância, cuja espécie química ocasiona um traço de cor correspondente bastante característico.
Com relação à espécie química componente da munição desse exército sabe-se:
I) A representação do elemento químico do átomo da espécie responsável pela coloração pertence à família dos metais alcalinos-terrosos da tabela periódica.
II) O átomo da espécie responsável pela coloração do traço possui massa de 137 u e número de nêutrons 81.
Sabe-se também que uma das espécies apresentadas na tabela do item III (que mostra a relação de cor emitida característica conforme a espécie química e sua distribuição eletrônica) é a responsável pela cor do traço da munição desse exército.
III) Tabela com espécies químicas, suas distribuições eletrônicas e colorações características:

Considerando os dados contidos, nos itens I e II, atrelados às informações da tabela do
item III, a munição traçante, descrita acima, empregada por esse exército possui traço de coloração
I. Com relação à afinidade eletrônica, a ordem correta é P > Se > Na > Cu.
II. Um metal alcalino terroso do terceiro período apresenta menor raio atômico do que um metal do quinto período e do mesmo grupo.
III. A primeira energia de ionização dos elementos decresce de cima para baixo num grupo ou família.
Está(ão) correta(s) a(s) afirmativa(s)
O fósforo branco é uma das formas alotrópicas do fósforo e foi usado durante a Primeira e a Segunda Guerras Mundiais como componente de munição incendiária capaz de causar terríveis queimaduras e problemas respiratórios.
Assinale a característica abaixo referente ao fósforo branco
Sódio e Potássio são elementos do grupo 1 da tabela periódica e possuem as seguintes características:
I - são excelentes condutores de eletricidade;
II - são metais moles e altamente reativos; e
III- possuem na camada eletrônica mais externa dois elétrons fortemente ligados ao núcleo atômico.
Assinale a opção correta.
ISÓTOPO ABUNDÂNCIA (%)
Fe54 5, 845
Fe56 91,754
Fe57 2,119
Fe58 0,282
Com relação às informações acima, analise as afirmativas abaixo.
I - A massa atômica do ferro a ser representada na tabela periódica deve se aproximar de 58.
II - Nesses isótopos o número de prótons é constante.
III- Esses isótopos são caracterizados por diferentes números de camadas eletrônicas nos átomos, no estado fundamental.
Assinale a opção correta.
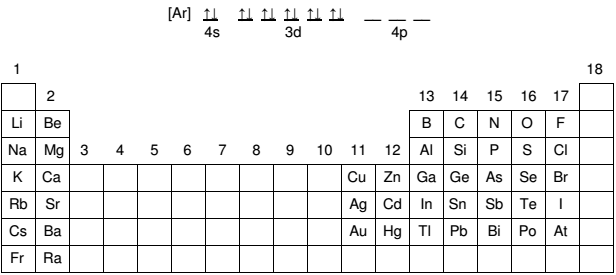
I - O índio é um mau condutor de eletricidade.
II – O raio atômico do índio é maior que o do estanho.
III – A densidade do índio é menor que a do paládio.
IV – O ponto de fusão do índio é maior que o do gálio.
Analisando as afirmativas acima, conclui-se que