Questões de Concurso
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 223 questões
Processo de Síntese de Formaldeído: CH4 + O2 → HCHO + H2O CH4 + 2O2 → CO2 + 2H2O
Processo de Síntese de Formaldeído: CH4 + O2 → HCHO +H2O CH4 + 2O2→ CO2 + 2H2O
2 NOCl (g) → 2 NO (g) + Cl2 (g)
O estudo cinético dessa reação indicou tratar-se de uma reação elementar com constante de velocidade igual a 0,020 L mol-1 s-1.
Nesse reator, para que a concentração de reagente caia de 0,100 para 0,040 mol L-1, o tempo, em segundos, é igual a
Nesse reator, o módulo da taxa de conversão do substrato, em mol L-1 s-1, é igual a
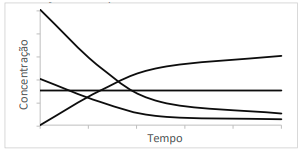
Considerando as letras mostradas no gráfico como símbolos para substâncias e o comportamento das curvas, assinale a equação que descreva corretamente a reação química que obedece às curvas apresentadas na imagem acima.
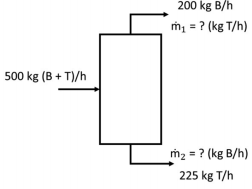
A vazão desconhecida (m1 e m2) dos componentes nas saídas do tanque, que pode ser calculada utilizando o balanço de massa sobre as espécies, é:
C3H8 + O2 → CO2 + H2O
Considerando a combustão completa do hidrocarboneto C3H8, com uma corrente contendo 440 kg/h de C3H8. Além disso, essa corrente é colocada em contato com uma corrente de ar. Admite-se que a percentagem mássica de gás oxigênio no ar é 20%, e que os demais componentes do ar não participam da reação de combustão. Dados: MMC3H8 = 44 g/mol; MMO2 = 32 g/mol. Assinale a alternativa correta.
Equação 1: Ω = √ 8RT/Mπ Equação 2: DK = 1/3 Ωdp
Determine o coeficiente de difusão do CO2 em uma partícula catalítica esférica de alumina a 30°C. Dados: rp = 96 Å; MMCO2 = 44 g; R = 8,31∙107 g cm2 /mol∙s2 ∙K; 1 Å = 1 10-10 m.