Questões de Concurso
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 200 questões
( ) Entalpia de reação é definida como a entalpia dos reagentes menos a dos produtos, sendo positiva para reações endotérmicas e negativa para reações exotérmicas.
( ) O calor padrão de combustão tabelado de uma substância depende do estado físico da substância.
( ) Se a entalpia de reação a uma determinada temperatura e pressão de um conjunto de reagentes é -850 kJ/mol, quando os produtos são formados no estado líquido, e -795 kJ/mol, quando os produtos são formados no estado gasoso, a entalpia de vaporização dos produtos dessa reação, na mesma temperatura e pressão, é 55 kJ.
( ) O calor padrão de combustão de hidrocarbonetos é definido como a energia liberada quando um mol do hidrocarboneto é reagido estequiometricamente com oxigênio, gerando como produtos gás carbônico e água, estando tanto os reagentes como os produtos a uma temperatura e pressão tomados como referência.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Em uma reação de oxirredução com potencial padrão de reação positivo e com diminuição na energia livre de Gibbs, é observado um processo espontâneo.
Assinale a opção que apresenta o valor correto do volume do segundo reator, em litros.
Considere que uma determinada indústria afirma que utiliza gás natural como combustível para a operação de uma caldeira em sua planta. No entanto, a análise da amostra dos gases da chaminé, logo após a caldeira, revela que há emissão de SO2 , indicando que o combustível utilizado não é gás natural.
Para a determinação do tipo de combustível, foram disponibilizadas as informações presentes nas seguintes tabelas.
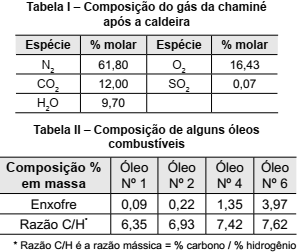
Dados: Massas molares C = 12 g/mol; H = 1 g/mol e S = 32 g/mol.
Considerando que o combustível seja composto apenas
por carbono, hidrogênio e enxofre, o óleo utilizado na
caldeira, de acordo com os dados da tabela II, é o de
número
Indústrias que operam com compostos sulfurados geralmente geram ácido sulfídrico (H2S), um gás altamente irritante para os olhos e vias respiratórias, além de possuir um odor desagradável de ovo podre. O processo Claus é uma alternativa para o tratamento desse poluente. Nele, parte do H2S é queimado em uma fornalha para se produzir SO2 , conforme apresentado na equação 1 a seguir.
H2S + 3/2 O2 → SO2 + H2O (1)
Os gases que saem da fornalha são misturados à outra parte de H2S e são alimentados em um reator catalítico, onde o enxofre elementar é formado, conforme equação 2 a seguir.
2H2S + SO2 → 2H2O + 3S (2)
Com base nesse processo, é correto afirmar que
Considere, em um sistema ideal, que uma chaminé recebeu 2,4 x 1019 moléculas de SO2 que foram misturadas com 10 g do carbonato de cálcio. Nessas condições, quantos miligramas, aproximadamente, de sulfato de cálcio ficariam retidos na chaminé?
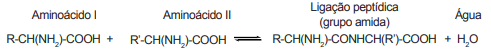 Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?
Considere que 2 mols de molécula do aminoácido I são adicionados para reagir com 1 mol de molécula do aminoácido II.
Quando o equilíbrio químico é estabelecido (equilíbrio 1), 20% do aminoácido I é consumido. Em seguida, adicionou-se
certa quantidade de mols de molécula do aminoácido II, e 10% do aminoácido I foi consumido até reestabelecer um novo
equilíbrio (equilíbrio 2).
Nessas condições, qual é a razão aproximada entre o primeiro e segundo equilíbrios?2H2 (g) + 2NO (g) → N2(g) + 2H2O (g)
Para compreender a velocidade da reação química em função das concentrações dos reagentes, um técnico realizou os seguintes experimentos.
Experimento 1 – Quando dobrou a concentração do gás hidrogênio e reduziu à metade a concentração do óxido nítrico, a velocidade da reação dobrou.
Experimento 2 – Quando quadruplicou a concentração do gás hidrogênio e dobrou a concentração do óxido nítrico, a velocidade da reação química quadruplicou.
A partir dessas informações, é correto afirmar que a expressão matemática da Lei de Velocidade é representada por:
Sendo assim, os reatores
Se a decomposição desse composto ocorre a 27°C, o valor aproximado da constante de velocidade, em s-1, é
Dados R = 8,31 J/mol.K ln (5x10-4 ) = -7,6
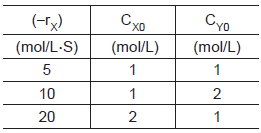
Com base nos dados da Tabela, a equação da velocidade pode ser
Sendo o rendimento da reação igual a 90%, a taxa de formação de CaCO3, em kg h-1 , corresponde a
Dados Massa molar do CO2 : 44 g mol-1 Massa molar do CaCO3 : 100 g mol-1
C4H6O3 + H2 O → 2 CH3COOH
A reação deverá produzir 20 kg/h de ácido acético, a constante de velocidade é aproximadamente 0,05 min-1 , a concentração inicial de anidrido acético é de 100 g/L, e a conversão, de 80%.
O volume aproximado, em litros, desse reator é
Dados Massa Molar do Ácido Acético (CH3COOH) = 60 g/mol Massa Molar do Anidrido Acético (C4H6O3 ) = 102 g/mol
Em uma etapa posterior, o reagente em excesso que não participou da reação é recuperado, sendo completamente separado do produto formado. A vazão de reagente recuperado, em kg h-1, é igual a
Dado Massas molares: C2H4 : 28 g mol-1, H2 : 2g mol-1

O volume do reator necessário para reduzir a concentração de saída a 20% da concentração de entrada é, aproximadamente,
Dado In 0,2 = -1,609

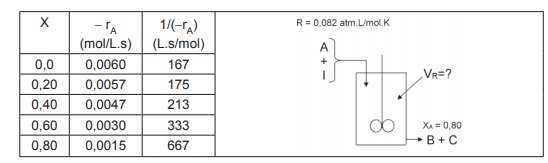
Usando os dados da Tabela e utilizando a Lei dos Gases Ideais, conclui-se que o volume do reator CSTR (em litros) necessário para alcançar uma conversão de 80% é
