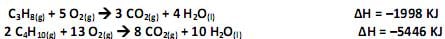Questões de Concurso
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 223 questões
INSTRUÇÃO: Para responder a questão, considere a seguinte equação de síntese da amônia:
N2(g) + 3 H2(g) ↔ 2NH3(g)
A figura a seguir mostra as curvas típicas de concentração-tempo para um esquema de reações.
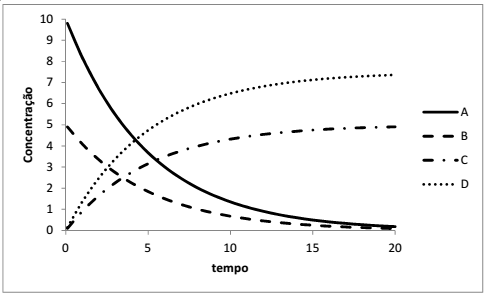
De acordo com as informações da figura, a sequência correta é
Um pesquisador trabalhando com os dados de
concentração (S) de um substrato enzimático e de
velocidade de reação (V), sem a presença de
inibidores, resolveu aplicar a equação de Michaelis-Mentem,
na sua forma linearizada, 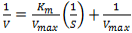 que, após o ajuste dos dados,
encontrou a seguinte expressão: y = 0,06.x + 0,02,
com R2
= 0,9982. Determine os valores de Vmax e Km.
que, após o ajuste dos dados,
encontrou a seguinte expressão: y = 0,06.x + 0,02,
com R2
= 0,9982. Determine os valores de Vmax e Km.
Foram estudados através de planejamento fatorial do tipo 22 os efeitos da temperatura e catalisador sobre o rendimento de uma reação química. Os dados experimentais obtidos são apresentados na tabela a seguir. Nos ensaios foram empregados dois níveis para a temperatura (40 e 50 °C) e dois tipos de catalisadores (A e B). Cada ensaio foi feito em duplicata.
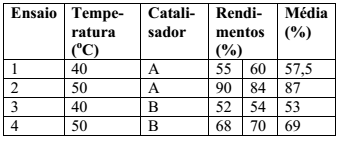
Analise as afirmativas a seguir com relação aos dados experimentais obtidos durante os ensaios.
I. Quando usamos o catalisador A e aumentamos a temperatura de 40 para 50 °C (ensaios 1 e 2), o rendimento médio aumenta em 29,5 %.
II. Quando usamos o catalisador B e modificamos a temperatura de 40 para 50 °C (ensaios 3 e 4), o rendimento médio aumenta em 16 %.
III. A 50 °C (ensaios 2 e 4) a mudança do tipo de catalisador diminui o rendimento médio da reação em 18 %.
IV. Não existe efeito de interação entre as variáveis estudadas (temperatura e tipo de catalisador) nesse planejamento experimental.
V. Elevando a temperatura, aumentamos o rendimento da reação, mas esse efeito é muito mais pronunciado com o catalisador B do que com o catalisador A.
Estão corretas:
Uma amostra de calcário (CaCO3), cuja pureza era de 60%, foi empregada na produção da CAL, através da decomposição térmica do material a 850 °C. Decompondo-se 500 kg de massa dessa amostra, obteve-se cal virgem (CaO) e gás carbônico (CO2). Admitindo-se um rendimento de 70% para essa reação, a quantidade de quilos de cal virgem obtida, vale:
(Considerar: C = 12 ; O = 16 ; Ca = 40.)
Um reator de pirólise, em escala de laboratório, é usado para a produção de bio-óleo e carvão durante o aproveitamento energético de biomassa residual, operando a uma vazão mássica de 0,5 kg/hora. Considerando os dados abaixo, podemos informar que os rendimentos dos produtos, carvão e óleo (respectivamente), após 30 minutos de operação do sistema, são aproximadamente:
Dados:
- Massa de carvão obtida no processo = 125 g
- Volume de bio-óleo recuperado = 70 mL
- Densidade do bio-óleo = 1,1 g/mL
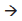 SO2(g ΔH = -297,0 kJ 2SO3
(g)
SO2(g ΔH = -297,0 kJ 2SO3
(g) 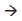 2SO2
(g) + O2
(g) ΔH = 198,0 kJ
2SO2
(g) + O2
(g) ΔH = 198,0 kJ segue-se que a variação da entalpia para a reação 2S(s) + 3O2 (g)
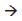 2SO3
(g) é:
2SO3
(g) é:Considere a evaporação de água de um reservatório, à temperatura ambiente, em um ambiente aberto cuja umidade é igual a 60%.
Nesse contexto, é incorreto afirmar que:
Acerca da termoquímica, da espontaneidade de reações e da ação de catalisadores, julgue o item a seguir.
Um processo é espontâneo se é acompanhado por uma
diminuição na entropia total do sistema e das
vizinhanças. Dessa forma, os processos espontâneos à
temperatura e pressão constantes são acompanhados
por um aumento da energia livre, ou seja, a direção da
mudança espontânea é a direção do aumento da energia
livre.
Considerando uma taxa parabólica de crescimento de filmes óxidos na superfície metálica quando o metal é submetido ao aquecimento a 600ºC em ambiente oxidante. Um metal A tem um revestimento óxido com espessura de 80 nm no instante t= 0 horas. Após 1 hora, a espessura estava em 160 nm. Qual será a espessura aproximada após 5 horas?
Considere y como sendo a espessura do filme, t como sendo o tempo de tratamento e C1 e C2 como constantes.
y2 = C1.t + C2
Assinale a alternativa correta:
CA a concentração da substância A a qualquer tempo t; CA0 a concentração da substância A no tempo inicial t0; K a constante de velocidade.
É possível calcular a concentração de A, após um determinado tempo de reação, por meio da equação:
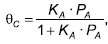 sendo:
sendo: KA – Constante. PA – Pressão parcial do componente A. θC – Grau de cobertura.
Portando, a expressão da derivada
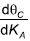 é dada por:
é dada por: