Questões de Concurso
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 223 questões
Em uma etapa posterior, o reagente em excesso que não participou da reação é recuperado, sendo completamente separado do produto formado. A vazão de reagente recuperado, em kg h-1, é igual a
Dado Massas molares: C2H4 : 28 g mol-1, H2 : 2g mol-1

O volume do reator necessário para reduzir a concentração de saída a 20% da concentração de entrada é, aproximadamente,
Dado In 0,2 = -1,609

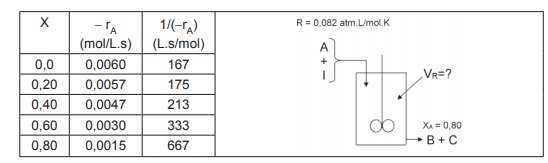
Usando os dados da Tabela e utilizando a Lei dos Gases Ideais, conclui-se que o volume do reator CSTR (em litros) necessário para alcançar uma conversão de 80% é
T (°C) T (K) K (L mol-1 s-1) ln k 161,63 434,78 148,42 5,00 104,20 377,35 1 0 60,18 333,33 0,0067 -5,0
A partir desses dados plotados na Figura abaixo, calcula-se a Energia de Ativação desta reação.
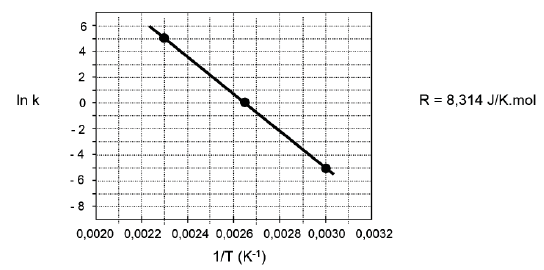
O valor da Energia de Ativação expresso em Joules/mol é
O tempo espacial, em minutos, é
NH3(g) ⇔
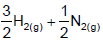
O valor correspondente de Kc (T) para essa reação no estado padrão de 1 mol L-1 é de
Dado Constante dos gases, R=0,083145 L.bar.mol-1 .K-1

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 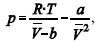 julgue o item que segue.
julgue o item que segue.
A partir do gráfico apresentado, conclui-se que o CO2 (g)
apresenta a constante b na equação de van der Waals inferior
à do O2 (g).

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 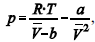 julgue o item que segue.
julgue o item que segue.
Quando atingida a pressão de 300 atm e a temperatura T2, o
volume ocupado pelo gás será menor do que aquele que seria
ocupado, nas mesmas condições, por um gás ideal.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 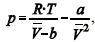 julgue o item que segue.
julgue o item que segue.
A uma pressão de 1,00 atm e temperatura de 300 K, o volume
ocupado pelo O2 (g) formado na decomposição de 4,00 mol de
H2O2 será superior a 46,0 L.
2 NO(g) + 2 H2(g) → N2(g) + 2 H2O(g)
foram determinadas em diferentes experimentos, nos quais as concentrações iniciais dos reagentes ([NO]0 e [H2]0) eram variadas.
Os resultados estão resumidos na tabela a seguir.
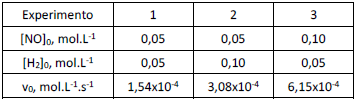
Nas condições deste experimento, a lei de velocidade da reação é
A velocidade de decomposição desse inseticida (nesta temperatura, em mol. L-1. ano-1), quando sua concentração em um corpo d’água for 5,00x10-9 mol.L -1 , será de
Os gráficos 1 e 2 a seguir referem-se a reatores tubulares não isotérmicos nos quais são realizadas reações reversíveis e devem ser utilizados na solução das questões 44 e 45.
Para melhorar o desempenho dos processos representados nos gráficos 1 e 2, respectivamente, deve ser considerado o emprego de:
Um engenheiro químico executa testes do tipo pulso de traçador em diferentes reatores reais e obtém como resposta as curvas de distribuição de tempos de residência (DTR´s) representadas a seguir.
A análise dessas curvas permite a seguinte constatação:
Um engenheiro químico trabalhando com a reação adiabática A⇄B obteve dados cinéticos, que foram tratados e representados no gráfico de Levenspiel a seguir.
Neste processo, deve-se empregar três reatores em série, dois CSTR´s e um PFR, arranjados livremente. Considerando que as conversões na saída dos reatores 1, 2 e 3 são 25%, 65% e 80%, respectivamente, o volume total (V1+V2+V3) mínimo do sistema de reatores é?
INSTRUÇÃO: Para responder a questão, considere os seguintes reatores:
I. Reator tanque agitado.
II. Reator batelada.
III. Reator fluxo pistão.
INSTRUÇÃO: Para responder a questão, considere os seguintes reatores:
I. Reator tanque agitado.
II. Reator batelada.
III. Reator fluxo pistão.
Associe os reatores às respectivas características:
( ) Os fluidos reagentes entram no reator, são misturados, em seguida os produtos formados são removidos.
( ) Os fluidos reagentes são bombeados através do reator e os produtos são formados ao longo do processo.
( ) Tanto os fluidos reagentes quanto os produtos podem entrar ou sair em regime batelada.
( ) Os fluidos reagentes podem entrar no reator em qualquer posição além da entrada.
( ) Os fluidos reagentes entram no reator, são misturados, e os produtos saem de forma contínua.
A sequência correta é:
Analise as afirmativas abaixo, sobre reatores químicos industriais, e marque (V) para Verdadeiro ou (F) para Falso.
( ) Os reatores podem ser classificados em homogêneos e heterogêneos.
( ) O reator de batelada é usado em fases homogênea e heterogênea.
( ) PFR é um reator tubular com agitação no qual todas as partículas escoam com a mesma velocidade na direção do fluxo.
( ) CSTR consiste de um tanque sem agitação com escoamento contínuo e sem acúmulo de reagentes ou produtos.
( ) O reator (PBR) assemelha-se ao reator tubular. A diferença é o “recheio” de partículas sólidas que existem nele.
A sequência correta é:
INSTRUÇÃO: Para responder a questão, considere a seguinte equação de síntese da amônia:
N2(g) + 3 H2(g) ↔ 2NH3(g)