Questões de Concurso
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 200 questões
O aumento da reatividade pela diminuição do tamanho das partículas está relacionado, entre outros fatores, ao aumento da área de contato superficial bem como à diminuição da capacidade de dissipação térmica dentro do próprio material piróforo.
As emulsões explosivas são pouco sensíveis ao choque mecânico, uma vez que a granulometria do material não afeta essa sensibilidade.
Um dos fatores que deve ser considerado na classificação de um material como alto explosivo é a velocidade da onda explosiva ou onda de choque.
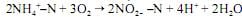
A oxidação dos nitritos a nitratos se dá, principalmente, pela atuação das bactérias, como as do gênero nitrobacter, conforme a reação:
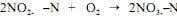 Considerando essas informações, julgue o item a seguir.
Considerando essas informações, julgue o item a seguir. A reação global da nitrificação é a soma das equações da transformação da amônia em nitritos com a equação da oxidação dos nitritos, isto é, NH4+SN + 2O2 → NO3- N + 2H+ + 6H2O.
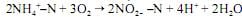
A oxidação dos nitritos a nitratos se dá, principalmente, pela atuação das bactérias, como as do gênero nitrobacter, conforme a reação:
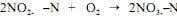 .Considerando essas informações, julgue o item a seguir.
.Considerando essas informações, julgue o item a seguir.Na predominância de anabolismo, a matéria orgânica presente na água residuária é utilizada pelos microrganismos para as suas atividades metabólicas de crescimento e obtenção de energia, fase que resulta no consumo de oxigênio e no aumento da população de microrganismos. A seguinte reação descreve essa etapa:
8CH2O + NH3 + 3O2 → C6H8NO3 + 3CO2 + H2O + energia.
A incorporação de óxido de magnésio em compostos cerâmicos iônicos reduz a temperatura de sinterização desses compostos.
A umidade absoluta é calculada pela razão da massa de vapor d’água no ar pela massa de ar seco, ao passo que a umidade relativa é determinada dividindo-se a pressão de vapor pela pressão atmosférica.
 , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

Considere que a reação de hidrogenação em apreço seja de ordem um com relação ao
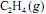 e de ordem um com relação ao
e de ordem um com relação ao 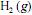 , e que as concentrações iniciais de cada um dos dois reagentes sejam iguais a
, e que as concentrações iniciais de cada um dos dois reagentes sejam iguais a  . Nessas condições, a concentração de
. Nessas condições, a concentração de 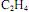 em um instante t da reação é dada por
em um instante t da reação é dada por 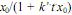 , em que k' é a constante de velocidade na temperatura da reação.
, em que k' é a constante de velocidade na temperatura da reação.  , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

A energia de ativação da reação de hidrogenação catalisada pelo metal B é superior à da reação catalisada pelo metal A.
 , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

Sob determinada temperatura, a reação de hidrogenação do
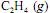 liberará maior quantidade de calor se realizada a volume constante, e não a pressão constante.
liberará maior quantidade de calor se realizada a volume constante, e não a pressão constante.  , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

A constante de equilíbrio para a reação de hidrogenação do
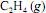 a 100 ºC é maior que a 25 ºC.
a 100 ºC é maior que a 25 ºC. 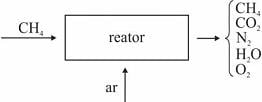
Em um reator ideal, de processo contínuo, que opera em estado estacionário, a combustão de
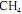 ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com
ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com 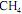 e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado.
e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado. Considerando que, nessa situação, a combustão do
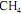 seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de
seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de 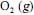 e, o restante, de
e, o restante, de 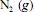 , julgue o item subsequente.
, julgue o item subsequente.A porcentagem, em massa, de
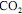 na corrente de saída do reator é superior a 10%.
na corrente de saída do reator é superior a 10%. 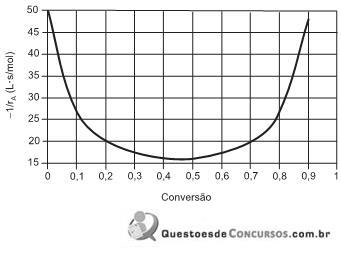
Considere uma reação que se processa em fase líquida em dada temperatura. Acima está representado o inverso da taxa de reação do reagente A em função de sua conversão. Se 30 mol/s do reagente A são alimentados a uma concentração de 3 mol/L, em um CSTR, desejando-se atingir uma concentração de 0,9 mol/L de reagente na saída, o volume do reator, em litros, será aproximadamente de
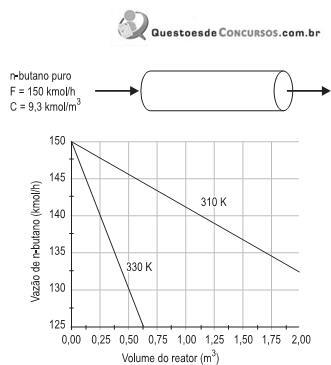
n-butano → i-butano r = k . C n-but
e onde r é a taxa de reação, C n-but é a concentração de n-butano, e k é constante da reação. A constante de reação segue a lei de Arrhenius, na forma
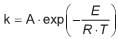
onde A é o fator pré-exponencial, E é a energia de ativação, R é a constante universal dos gases, e T é a temperatura. O valor de de E/R , em K, é dado por
 onde β é tal que
onde β é tal que
CO(g) + H2 O(g) ↔ CO2(g) + H2(g) (1)
Nessa temperatura, a constante de equilíbrio da reação assume o valor de K1 = 54,6. Além disso, a corrente de alimentação do reator contém água e monóxido de carbono na razão molar de 2:1, respectivamente.
Sabendo-se que a razão molar entre água e dióxido de carbono na saída do reator é de 1,035, a razão molar entre hidrogênio e monóxido de carbono na saída do reator é de
Sendo R a constante dos gases, o trabalho de compressão deste gás é dado por:
(hi representa a entalpia molar do composto i)
hCO(370 o C) - hCO(300 o C) = 2,2 x 103 J/mol
hH2O(370 o C) - hH2O(300 o C) = 2,6 x 103 J/mol
calor de reação a 370 o C ≈ -4 x 104 J/mol
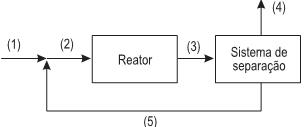
No processo ilustrado na Figura acima, operando em regime permanente, ocorre a reação R→ Produtos. Seja QR,i a vazão molar do composto R na corrente i.
Se Q R,5 /QR,3 é igual a 0,8, e a conversão de R por passe é igual a 0,5, a conversão global de R é, aproximadamente, igual a
Em uma sala de pesquisa, um cilindro de gás, em base volumétrica com 50% de metano e 50% de uma mistura O2 /N2 com composição similar à do ar atmosférico, alimenta um reator a uma vazão de 2 mol . min-1 .
Em caso de vazamento da mistura para tal sala, admitindo que tal sala esteja totalmente fechada e contenha inicialmente 1.800 mols de ar atmosférico, o gás na sala atingirá o limite mínimo de inflamabilidade em quantos minutos?
Com o uso do novo catalisador, a taxa reacional no processo FCC