Questões de Concurso
Sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 223 questões
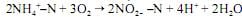
A oxidação dos nitritos a nitratos se dá, principalmente, pela atuação das bactérias, como as do gênero nitrobacter, conforme a reação:
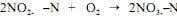 .Considerando essas informações, julgue o item a seguir.
.Considerando essas informações, julgue o item a seguir.Na predominância de anabolismo, a matéria orgânica presente na água residuária é utilizada pelos microrganismos para as suas atividades metabólicas de crescimento e obtenção de energia, fase que resulta no consumo de oxigênio e no aumento da população de microrganismos. A seguinte reação descreve essa etapa:
8CH2O + NH3 + 3O2 → C6H8NO3 + 3CO2 + H2O + energia.
A incorporação de óxido de magnésio em compostos cerâmicos iônicos reduz a temperatura de sinterização desses compostos.
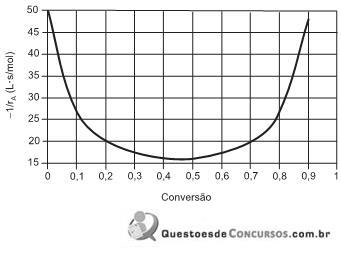
Considere uma reação que se processa em fase líquida em dada temperatura. Acima está representado o inverso da taxa de reação do reagente A em função de sua conversão. Se 30 mol/s do reagente A são alimentados a uma concentração de 3 mol/L, em um CSTR, desejando-se atingir uma concentração de 0,9 mol/L de reagente na saída, o volume do reator, em litros, será aproximadamente de
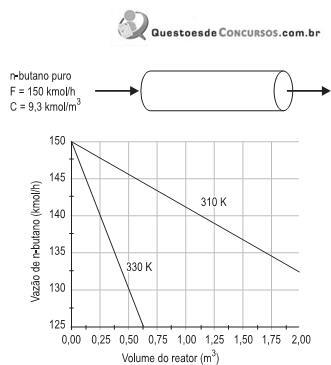
n-butano → i-butano r = k . C n-but
e onde r é a taxa de reação, C n-but é a concentração de n-butano, e k é constante da reação. A constante de reação segue a lei de Arrhenius, na forma
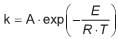
onde A é o fator pré-exponencial, E é a energia de ativação, R é a constante universal dos gases, e T é a temperatura. O valor de de E/R , em K, é dado por
 onde β é tal que
onde β é tal que
CO(g) + H2 O(g) ↔ CO2(g) + H2(g) (1)
Nessa temperatura, a constante de equilíbrio da reação assume o valor de K1 = 54,6. Além disso, a corrente de alimentação do reator contém água e monóxido de carbono na razão molar de 2:1, respectivamente.
Sabendo-se que a razão molar entre água e dióxido de carbono na saída do reator é de 1,035, a razão molar entre hidrogênio e monóxido de carbono na saída do reator é de
Sendo R a constante dos gases, o trabalho de compressão deste gás é dado por:
(hi representa a entalpia molar do composto i)
hCO(370 o C) - hCO(300 o C) = 2,2 x 103 J/mol
hH2O(370 o C) - hH2O(300 o C) = 2,6 x 103 J/mol
calor de reação a 370 o C ≈ -4 x 104 J/mol
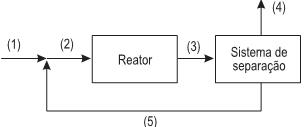
No processo ilustrado na Figura acima, operando em regime permanente, ocorre a reação R→ Produtos. Seja QR,i a vazão molar do composto R na corrente i.
Se Q R,5 /QR,3 é igual a 0,8, e a conversão de R por passe é igual a 0,5, a conversão global de R é, aproximadamente, igual a
Em uma sala de pesquisa, um cilindro de gás, em base volumétrica com 50% de metano e 50% de uma mistura O2 /N2 com composição similar à do ar atmosférico, alimenta um reator a uma vazão de 2 mol . min-1 .
Em caso de vazamento da mistura para tal sala, admitindo que tal sala esteja totalmente fechada e contenha inicialmente 1.800 mols de ar atmosférico, o gás na sala atingirá o limite mínimo de inflamabilidade em quantos minutos?
Acerca dos métodos, substâncias e reatores utilizados em sistemas de biocatalisadores imobilizados, julgue os itens a seguir.
Solubilização do suporte, padrão irregular de fluxo no interior do reator e envenenamento não alteram o desempenho dos reatores com enzimas imobilizadas.
O alto rendimento de um processo fermentativo está diretamente relacionado à correta análise, escolha, projeto e utilização de um biorreator adequado às necessidades intrínsecas do processo. Com relação a esse assunto, julgue os itens que se seguem.
A fermentação alcoólica pode ser realizada por meio de biorreatores que operam com elevadas concentrações celulares (high cell density cultures), o que resulta em alta velocidade de conversão do substrato em produto.
O alto rendimento de um processo fermentativo está diretamente relacionado à correta análise, escolha, projeto e utilização de um biorreator adequado às necessidades intrínsecas do processo. Com relação a esse assunto, julgue os itens que se seguem.
Os reatores com lâminas de membranas planas e os reatores de fibra oca apresentam a desvantagem de não proporcionarem a separação entre os fluxos de nutrientes e os fluxos de produtos metabólicos.
Com relação à cinética enzimática e à cinética de crescimento celular, julgue os próximos itens.
A duração da fase lag ou fase de latência varia de acordo com a concentração do inóculo e com a idade e o estado fisiológico do microrganismo.
Fundada por Isaac Benayon Sabbá, a Refinaria Isaac Sabbá ou Refinaria de Manaus (REMAN) iniciou suas operações em 6 de setembro de 1956, com o nome de Companhia de Petróleo da Amazônia (COPAM). Foi oficialmente inaugurada em 3 de janeiro de 1957. Possui a primeira unidade de Craqueamento Catalítico de Petróleo da América Latina. O craqueamento catalítico acontece na primeira etapa do processo, que envolve preferencialmente um reator de leito fluidizado, que torna o processo contínuo. Para fluidizar um leito de partículas em um cilindro vertical, um fluido (gasóleo) é injetado na base do reator. O movimento do particulado é promovido vigorosamente a fim de obter-se um bom contato entre o sólido e o gás, com a finalidade principal de promover as reações desejadas, que ocorrem na superfície do sólido (catalisador).
O reator mencionado no texto é corretamente classificado como
Em uma reação de oxirredução com potencial padrão de reação positivo e com diminuição na energia livre de Gibbs, é observado um processo espontâneo.
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue o item a seguir.
Se a taxa de formação da amônia for de 3,2 × 10-2 mol.L-1 .s- 1 , então as taxas de consumo dos gases N2 e H2, serão, respectivamente, 1,6 × 10-2 mol.L-1 .s-1 e 4,8 × 10-2 mol . L- 1.s -1 .
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue o item a seguir.
A partir do gráfico, é correto concluir que a reação envolvida
é de ordem zero e que o módulo do valor da inclinação da reta
representa a constante de velocidade da reação de consumo
da amônia.
