Questões de Concurso Sobre engenharia química e química industrial
Foram encontradas 2.820 questões
Julgue o item subsecutivo, com relação a processos industriais de separação de sólidos e líquidos.
Durante todo o processo de decantação, é possível distinguir
apenas duas zonas: a do líquido clarificado e a de
compactação, que se adensa com o decorrer do tempo.
Julgue o item subsecutivo, com relação a processos industriais de separação de sólidos e líquidos.
Apesar de decantadores e centrífugas envolverem diferentes
tipos de força motriz para separação de fases, em ambos os
dispositivos a separação de duas ou mais fases se dá pela
diferença de densidade entre elas.
Julgue o item subsecutivo, com relação a processos industriais de separação de sólidos e líquidos.
Para auxiliar o processo de filtração, é correto o uso de
sólidos compressíveis, os quais contribuem para a
diminuição da queda de pressão.
Julgue o item subsecutivo, com relação a processos industriais de separação de sólidos e líquidos.
Durante uma filtração, a formação da torta aumenta a queda
de pressão.
A respeito do processo de classificação de sólidos no qual se utiliza uma sequência de peneiras, com malhas diferentes, dispostas sobre uma mesa vibratória, julgue o item que se segue.
Na classificação de sólidos por peneiras, o entupimento da
peneira é um problema recorrente quando o sólido possui
diâmetros médios de partícula similares ao da abertura das
malhas.
A respeito do processo de classificação de sólidos no qual se utiliza uma sequência de peneiras, com malhas diferentes, dispostas sobre uma mesa vibratória, julgue o item que se segue.
Em um experimento real de peneiramento, sempre ocorre a
retenção de partículas finas juntamente com partículas mais
grossas e de partículas grossas em frações de partículas mais
finas.
A respeito do processo de classificação de sólidos no qual se utiliza uma sequência de peneiras, com malhas diferentes, dispostas sobre uma mesa vibratória, julgue o item que se segue.
O tamanho médio de partícula da fração retida em uma
peneira corresponde à média entre a abertura dessa peneira
com a abertura da peneira que estiver imediatamente acima
dela.
A respeito do processo de classificação de sólidos no qual se utiliza uma sequência de peneiras, com malhas diferentes, dispostas sobre uma mesa vibratória, julgue o item que se segue.
Em laboratórios onde se classificam os sólidos por meio de
peneiras, o tempo de peneiramento é geralmente inferior a
1 minuto: basta vibrar o sólido particulado por poucos
segundos para que a separação ocorra pela ação da
gravidade.
A respeito do processo de classificação de sólidos no qual se utiliza uma sequência de peneiras, com malhas diferentes, dispostas sobre uma mesa vibratória, julgue o item que se segue.
As peneiras devem ser empilhadas de forma ordenada: a
peneira com maior mash deve ser colocada na base da pilha,
e a com menor mash, na parte superior da pilha.
Acerca dos medidores de vazão dos tipos rotâmetro e tubo de Pitot, julgue o item a seguir.
Em um tubo de Pitot, independentemente do esquema de
construção adotado, as duas aberturas deverão ser paralelas à
direção do fluido cuja velocidade se pretende medir.
Acerca dos medidores de vazão dos tipos rotâmetro e tubo de Pitot, julgue o item a seguir.
Ao se medir a diferença entre as pressões estática e
estagnante utilizando-se um tubo de Pitot, é possível
determinar a velocidade de um fluido.
Acerca dos medidores de vazão dos tipos rotâmetro e tubo de Pitot, julgue o item a seguir.
A queda de pressão ao longo do flutuador de um rotâmetro é
constante.
Acerca dos medidores de vazão dos tipos rotâmetro e tubo de Pitot, julgue o item a seguir.
Conforme o esquema de construção do rotâmetro, a direção e
o sentido de escoamento do fluido dentro do medidor
poderão variar de acordo com a necessidade da instalação
industrial.
Acerca dos medidores de vazão dos tipos rotâmetro e tubo de Pitot, julgue o item a seguir.
A posição de equilíbrio do flutuador de um rotâmetro é
determinada por apenas duas forças contrárias: a força
gravitacional e o empuxo exercido pelo fluido na sua base.
Acerca de bombas, julgue o próximo item.
Situação hipotética: Na figura a seguir, as curvas identificadas por 1, 2 e 3 correspondem, respectivamente, a bomba alternativa de êmbolo, bomba alternativa de êmbolo de vários cilindros e bomba alternativa de diafragma. As curvas identificadas por 4 e 5 correspondem, respectivamente, a bomba rotatória de rodas dentadas e bomba rotatória de parafuso.
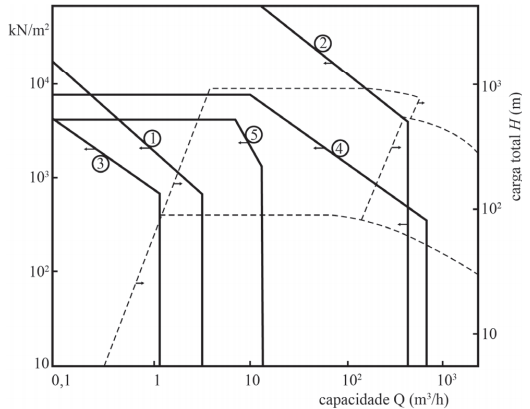
Assertiva: Para uma vazão de 1 m³
/h e pressão de
104 kN/m2
, a bomba rotatória de rodas dentadas é a escolha
mais adequada entre todas as bombas mencionadas.
Acerca de bombas, julgue o próximo item.
Infere-se da figura seguinte que a curva bombas associadas corresponde à associação em paralelo das bombas 1 e 2.
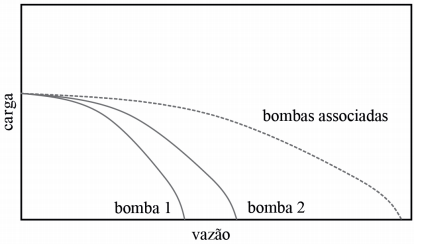
Acerca de bombas, julgue o próximo item.
As curvas características das bombas representam a carga ou
a pressão frente à vazão e somente podem ser alteradas em
função do regime de giro do rotor.
Com relação a perdas de carga, julgue o item a seguir.
No cálculo das perdas de carga, é necessário considerar o
diâmetro equivalente hidráulico, parâmetro que depende do
perímetro do duto e de sua seção transversal. No caso de
tubulações de seções quadradas, o diâmetro equivalente é
igual ao comprimento do lado do tubo.
Com relação a perdas de carga, julgue o item a seguir.
Em regime laminar, as perdas de carga por atrito
independem da rugosidade da tubulação.
Acerca de transporte de fluidos compressíveis, julgue o item que se segue.
A densidade de fluidos compressíveis depende das condições
de operação, assim, em cálculos que envolvam esses fluidos,
é conveniente considerar as vazões ou velocidades mássicas.