Questões de Concurso Sobre engenharia química e química industrial
Foram encontradas 2.374 questões
Assumindo que o dióxido de carbono apresente comportamento de gás ideal, sua densidade, em kg m-3, nessas condições, é aproximadamente igual a
Dados Massa molar do dióxido de carbono: 44 g mol-1 Constante universal dos gases ideais: 8,31 Pa m3 mol-1 K-1
Um técnico precisa austenitizar dois aços ao carbono com (aço A) 0,3% massa de C e (aço B) 0,75% massa de C.
Considerando-se o diagrama de equilíbrio do sistema Fe-C, a melhor temperatura para tratar simultaneamente os dois aços é:
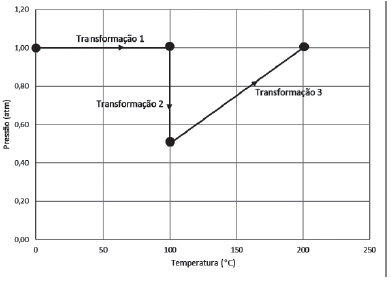
Considerando-se o hélio um gás ideal, a transformação
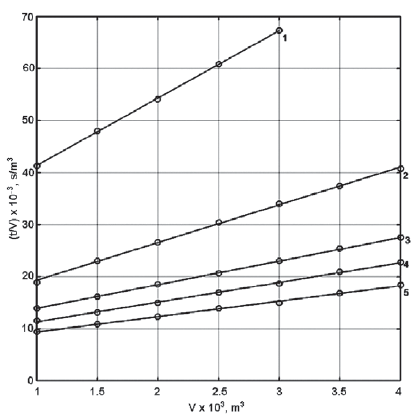
Analisando-se os coeficientes linear e angular de cada reta, verifica-se que o experimento conduzido com o menor Δp foi o
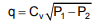
em que a constante Cv foi estimada por regressão não linear.
Considerando-se as três dimensões fundamentais MLt, a dimensão de Cv para consistência dimensional é
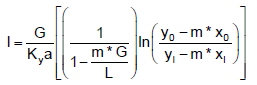
tal que G e L são, respectivamente, as vazões molares de gás e líquido por unidade de área (em kgmol/sm2); m* é a constante de equilíbrio; Ky a é o coeficiente global de transferência de massa vezes a área por volume (em kgmol/sm); y0 e yl são as frações molares do soluto no gás na entrada e na saída da torre, respectivamente, e x0 e xl são as frações molares do soluto no solvente na saída e na entrada da torre, respectivamente.
Para um dado problema, os valores numéricos (no sistema SI) são conhecidos, e os termos da equação acima foram calculados, aproximadamente, como:
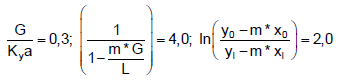
tal que as unidades (quando há) foram omitidas aqui propositadamente.
Usando-se o conceito da literatura de “número de unidades de transferência” (NTU) e “altura de uma unidade de transferência” (HTU), tem-se, nesse caso:
Admitindo-se que uma corrente orgânica (30% em massa do soluto e 70% do diluente original), com vazão mássica total F kg/s é misturada com um solvente (puro) à vazão de 0,5 F kg/s, o ponto M tem composição percentual em massa de soluto, diluente original e solvente dadas, aproximadamente, por
Desconsiderando-se as perdas de carga maiores e menores, NPSHA, em metros, e a vazão volumétrica de operação para uma operação segura de cavitação são assim determinados:
Dado altura de sucção positiva líquida requerida: 4 metros Pressão de vapor do líquido: 4,25 kPa Massa específica: 1000 kg/m3
A vazão volumétrica, em m3/s nessa tubulação, é de, aproximadamente,
Dado Massa específica da água: 1000 kg/m3 Aceleração da gravidade: 10 m/s2 Massa específica do fluido de trabalho: 790 kg/m3 Coeficiente de vazão: 0,8
Para que a observação do engenheiro responsável seja verdade para uma tubulação de diâmetro 0,1 m, que escoa um fluido de massa específica 1000 kg/m3 e viscosidade dinâmica de 0,00001 Pa.s, a vazão volumétrica, em m3/s, é de
Desconsiderando-se os efeitos de perda de carga menores e maiores, a vazão de operação da bomba, em m3/s, é de
Dado Calor específico de gás ideal k* = 1,25 para uma temperatura de 400 K
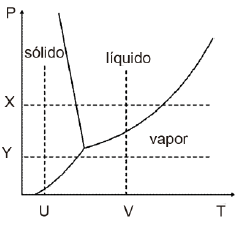
Nesse contexto, em referência ao diagrama, a passagem de
C4H6O3 + H2 O → 2 CH3COOH
A reação deverá produzir 20 kg/h de ácido acético, a constante de velocidade é aproximadamente 0,05 min-1 , a concentração inicial de anidrido acético é de 100 g/L, e a conversão, de 80%.
O volume aproximado, em litros, desse reator é
Dados Massa Molar do Ácido Acético (CH3COOH) = 60 g/mol Massa Molar do Anidrido Acético (C4H6O3 ) = 102 g/mol
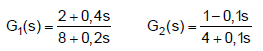
Para controle dessas malhas, um engenheiro deve levar em consideração vários fatores, como estabilidade, margem de fase, ganho, entre outros.
Nesse caso, em relação às funções de transferência G1(s) e G2(s), tem-se o seguinte:
da = –sdT – Pdv
Utilizando-se as relações de Maxwell e a equação de estado do gás ideal (PV = RT), a relação (∂s/∂v)T para um gás ideal é
Em uma etapa posterior, o reagente em excesso que não participou da reação é recuperado, sendo completamente separado do produto formado. A vazão de reagente recuperado, em kg h-1, é igual a
Dado Massas molares: C2H4 : 28 g mol-1, H2 : 2g mol-1
A corrente X é encaminhada para a segunda etapa, sendo separada em duas novas correntes: W e Z. A corrente W tem vazão de 80 kg h-1 e contém 95% de A. Por sua vez, a corrente Z tem vazão de 20 kg h-1 e contém 20% de A.
A concentração percentual de A na corrente de alimentação é igual a
A pressão parcial de CH4 nessa mistura é igual a
A massa da amostra, em gramas, de N2 líquido que evaporou é igual a
Dado Massa molar do N2 : 28 g mol-1