Questões de Farmácia - Farmacovigilância para Concurso
Foram encontradas 1.550 questões
Com referência a controle de infecção hospitalar, farmacovigilância e hemovigilância, julgue o próximo item.
O serviço de hemoterapia deve manter os registros dos
eventos adversos detectados em todas as etapas do ciclo do
sangue, disponibilizá-los e sempre enviá-los à autoridade
sanitária de forma consolidada, independentemente de
solicitação.
Quando se observa, antes de o medicamento ser administrado a um paciente, que este é diferente daquele que foi prescrito, interrompendo a sequência de falhas assistenciais é, então, definido que o ocorrido se trata de:
I. Farmacovigilância é definida como a ciência e atividades relativas à identificação, avaliação, compreensão e prevenção de efeitos adversos ou quaisquer problemas relacionados ao uso de medicamentos.
II. Na Farmacovigilância, podem ser notificados as suspeitas de reações adversas a medicamentos, eventos adversos causados por desvios da qualidade de medicamentos, inefetividade terapêutica, erros de medicação, uso abusivo, intoxicações e interações medicamentosas.
III. O VigiMed é o sistema de notificação de eventos adversos relacionados ao uso de medicamentos e vacinas, disponível no portal eletrônico do governo federal sob gestão da Agência Nacional de Vigilância Sanitária (Anvisa), exclusivo aos profissionais de saúde para relatarem as suspeitas de eventos adversos aos medicamentos e às vacinas.
IV. A Farmacovigilância tem como objetivo a identificação de sinais, que são definidos como informações sobre uma possível relação causal entre um evento adverso e o uso de um medicamento, sendo essa relação desconhecida ou documentada de forma incompleta.
Assinale a alternativa CORRETA.
Em um hospital, um farmacêutico rastreia diariamente todos os pacientes em uso de Rituximabe e os visita pessoalmente aplicando um questionário sobre possíveis reações adversas que eles tenham experimentado durante a infusão do medicamento. Trata-se de uma estratégia do tipo
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.
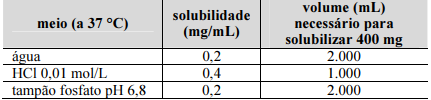
Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
De acordo com o sistema de classificação biofarmacêutica (SCB), os medicamentos contendo benzoilmetronidazol devem passar
por estudos de bioequivalência devido à sua baixa solubilidade.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.

Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
No caso em tela, a bioisenção para as demais dosagens fica condicionada à comprovação da farmacocinética linear.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.

Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
A forma farmacêutica do medicamento genérico descrito não está incluída da lista de formas farmacêuticas sujeitas à bioisenção
da ANVISA.
Uma empresa está desenvolvendo um medicamento genérico apresentado na forma de comprimidos orais contendo 250 mg ou 400 mg do fármaco benzoato de metronidazol, um éster do metronidazol, também denominado benzoilmetronidazol, cujo medicamento de referência é o Flagyl®. O benzoilmetronidazol possui as seguintes solubilidades.

Bempong et al., J. Pharm. Biomed. Anal., 2005 (com adaptações).
De acordo com o regramento da ANVISA, os medicamentos genéricos orais de liberação imediata contendo metronidazol poderão ser candidatos à bioisenção baseada no sistema de classificação biofarmacêutica (SCB). Nesse contexto e considerando a situação hipotética apresentada, julgue o item que se segue.
O metronidazol apresenta alta permeabilidade intestinal.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
A documentação para a solicitação do registro deve
apresentar os estudos de estabilidade acelerada nas condições
previstas para a zona climática II, que representa o local de
produção do medicamento.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
No ato do protocolo do pedido de registro, deverão ser
apresentados um plano de farmacovigilância e um plano de
minimização de risco.
Uma empresa farmacêutica, com fábrica na Europa, está prestes a solicitar o registro na ANVISA de um novo medicamento obtido por procedimentos biotecnológicos. Especificamente, um gene humano, quando introduzido em células de cenoura, as induz a produzirem uma enzima, que é, então, coletada e purificada para uso como medicamento.
Considerando a situação hipotética apresentada, julgue o item a seguir.
A solicitação deve se basear na regulamentação vigente para
o registro de fitoterápicos, ou seja, medicamentos obtidos
empregando-se matérias-primas vegetais.
Um centro de pesquisa clínica no Brasil foi contratado
para realizar um estudo clínico, patrocinado por uma indústria
farmacêutica, para avaliação de uma nova forma farmacêutica
para tratamento da hipertensão arterial, seguindo regulamentação
padrão da ANVISA no que se refere a responsabilidades. O
protocolo foi aprovado em 10 de janeiro de 2023 pelo
competente comitê de ética em pesquisa, e todos os documentos
pertinentes foram aprovados pela ANVISA no prazo de 90 dias
corridos. O primeiro participante foi incluído no estudo clínico
em 10 de maio do mesmo ano. Após a administração do novo
medicamento em cinco participantes, foi realizada a inclusão de
um novo desfecho secundário ao protocolo, para avaliar o
impacto do medicamento no bem-estar emocional dos pacientes e
na sua qualidade de vida, utilizando-se questionários validados
específicos. No decorrer do estudo, um participante apresentou
hipotensão, tontura e perda de consciência, o que demandou sua
hospitalização e a administração de fluidos intravenosos a ele.
Foi estabelecida relação de causalidade entre esse ocorrido e a
administração da medicação-teste.
Considerando essa situação hipotética, julgue o item a seguir.
O caso relatado de tontura representa, por definição, um
evento adverso grave.