Questões de Concurso
Sobre validação de métodos analíticos e garantia da qualidade em farmácia
Foram encontradas 518 questões
Com relação aos métodos analíticos, julgue os item que se segue.
A difração de pó de raios X (XRPD) é uma técnica adequada
para determinar o grau de cristalinidade de uma substância
medicamentosa e a composição de uma mistura heterogênea,
para estudar fenômenos de polimorfismo e solvatomorfismo
e reações induzidas termicamente e, também, para realizar
estudos de estabilidade.
Com relação aos métodos analíticos, julgue os item que se segue.
Por possuírem as mesmas propriedades físicas e químicas,
dois
enantiômeros do mesmo composto apresentam
interações idênticas a outras moléculas quirais, devido à
semelhança no arranjo espacial dos átomos e, portanto, na
afinidade de ligação a uma fase estacionária quiral.
Dentre as atividades apresentados a seguir, atribuídas ao farmacêutico em uma farmácia de manipulação, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) Prever e prover os recursos financeiros, humanos e materiais necessários ao funcionamento do estabelecimento.
( ) Determinar o prazo de validade para cada produto manipulado.
( ) Manipular a formulação de acordo com a prescrição e / ou supervisionar os procedimentos para que seja garantida a qualidade exigida.
( ) Garantir que a validação dos processos e a qualificação dos equipamentos, quando aplicáveis, sejam executadas e registradas e que os relatórios sejam colocados à disposição das autoridades sanitárias.
Assinale a sequência correta.
( ) Boas Práticas de Armazenagem envolvem aspectos como: limpeza e higienização; delimitação dos espaços para adequada estocagem e recebimento.
( ) É caracterizado por um conjunto de procedimentos técnicos e administrativos que envolvem atividades como o controle de estoque.
( ) Os medicamentos devem ser organizados de forma que permita a fácil identificação, por exemplo: por nome genérico, lote e validade. Não é necessário que os medicamentos sejam conservados em suas embalagens primárias.
( ) Os produtos devem ser armazenados obedecendo às condições técnicas ideais de luminosidade, temperatura e a umidade. Devem-se registrar semanalmente a temperatura e a umidade do ambiente por meio de termohigrômetros.
( ) As caixas não devem ser arrastadas e é importante observar o empilhamento máximo permitido para o produto, de acordo com as recomendações do fabricante.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
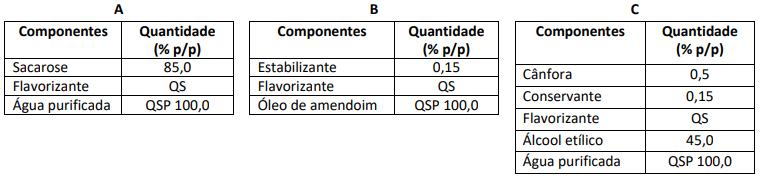
Assinale a opção que descreve uma consequência da situação acima.
Assinale a opção que corresponde ao benefício da creditação.
Segundo a Norma ISO 17025, analise as afirmativas a seguir.
I. É facultado ao laboratório validar métodos não normalizados, métodos desenvolvidos pelo laboratório e métodos normalizados, utilizados fora de seu escopo pretendido ou modificado de outra forma.
II. O laboratório deve ter um plano e um método de amostragem, quando realiza amostragem de substâncias, materiais ou produtos para ensaio ou calibração subsequente.
III. O laboratório deve ter um sistema para a identificação não ambígua de itens de ensaio ou calibração.
É correto o que se afirma
De acordo com as boas práticas de armazenamento e distribuição de medicamentos, qual das seguintes medidas é recomendada para garantir a segurança e a qualidade dos produtos?