Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 305 questões
Com relação às aplicações da química e aos processos eletroquímicos, julgue o item que se segue.
A substância capaz de promover a redução de outra substância é denominada de agente redutor, enquanto a substância responsável pela oxidação de outra substância é denominada de agente oxidante.
Para a remoção de cromo hexavalente (Cr6+) pode-se utilizar dióxido de enxofre (SO2). A redução do Cr6+ se dá em meio ácido com pH entre 2 e 3. Após a neutralização com hidróxido de cálcio [Ca(OH)2], em pH 8 a 9, o cromo precipita como hidróxido de cromo III (Cr(OH)3). As reações envolvidas são:
− Redução: 3 SO2 + 2 H2CrO4 + 3 H2O → Cr2(SO4)3 + 5 H2O
− Precipitação: Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)3 + 3 CaSO4
− Estequiometricamente é necessário na redução 2,0 g de SO2/g Cr6+ e de 2,0 g de H2SO4 / g Cr6+
− Na precipitação utiliza-se 2,6 g de Ca(OH)2 /g Cr6+
Para tratar um efluente de 8,0 m3 contendo 0,50 g de g Cr6+/L de efluente, o consumo de SO2, H2SO2 e Ca(OH)2 são, respectivamente:
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
A proteção catódica é um método utilizado para a proteção de estruturas. Com isso, tubulações e tanques de estocagem, entre outros, são protegidos por esse método. Em uma aula de química, deseja-se estudar a proteção da corrosão de um equipamento constituído basicamente por ferro, empregando-se o método da proteção catódica com o uso de um metal de sacrifício. Nesse contexto, a tabela a seguir mostra os potenciais-padrão de redução (E°) de algumas espécies.

1) H2S (aq) + 4 Cl2 (aq) + 4 H2O (liq)
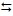 8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)
8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq) 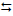 2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq)
2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq) 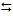 MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
Analise as afirmativas a seguir, relacionadas com as reações.
I. Na reação 1, o enxofre sofre oxidação e o cloro é o agente redutor. II. Na reação 2, o ferro sofre oxidação e o cloro sofre redução. III. Na reação 3, o manganês sofre redução e o cloro é o agente oxidante.
Está correto o que se afirma em
O rompimento de uma adutora de 700 mm de diâmetro na tarde de quinta-feira do dia 22 de março de 2018, localizada no quilômetro 59 da via marginal da Anhanguera, afetou o abastecimento de água em alguns bairros de Jundiaí (SP).
(Adaptado de: https://g1.globo.com)
Esse evento pode ocorrer devido à corrosão eletroquímica. Em tubulações de ferro é adequado fazer proteção catódica, utilizando ânodos fixados na tubulação que fica submersa no solo.
Considere os seguintes potenciais de redução, a 25,0 °C:
Fe2+(aq) + 2 e− ⇋ Fe(s) Eo = −0,440 V
Cu2+ (aq) + 2 e− ⇋ Cu(s) Eo = +0,337 V
Sn2+ (aq) + 2 e− ⇋ Sn(s) Eo = −0,136 V
Ni2+ (aq) + 2 e− ⇋ Ni(s) Eo = −0,250 V
Co2+ (aq) + 2 e− ⇋ Co(s) Eo = −0,277 V
Zn2+ (aq) + 2 e− ⇋ Zn(s) Eo = −0,763 V
O metal mais apropriado como ânodo é o
Oxirredução é um processo em que ocorre transferência de elétrons entre as espécies no decorrer de uma reação química.
K2Cr2O7 (aq) + 4 H2SO4 (aq) + 3 C2H5OH (aq) → 3 C2H4O (g) + K2SO4 (aq) + Cr2 (SO4)3 (aq) + 7 H2O (l)
Considerando a reação entre dicromato de potássio (K2Cr2O7) com álcool etílico (C2H5OH) na presença de ácido sulfúrico
(H2SO4),
Considere os seguintes potenciais de redução, a 25,0 °C:
Cu2+(aq) + 2 e− ⇋ Cu (s) Eo = +0,337 V
Ag+(aq) + e− ⇋ Ag (s) Eo = +0,799 V
Quando um fio de cobre (Cu) é imerso numa solução aquosa de nitrato de prata (AgNO3), ocorre uma reação de óxido redução devido a
A reação de oxirredução que ocorre numa pilha de lítio é representada simplificadamente a seguir:
2 Li(s) + I2(s) → 2 Li+ (aq) + 2 I- (aq)
Dados os potenciais padrões de redução:
• Eº Li+ /Li = -3,05 V
• Eº I2 /I- = +0,53 V
verifica-se que a diferença de potencial padrão dessa pilha,
em volts, é
A reação a seguir é muito útil em procedimentos para determinação do teor de ferro.
SnCℓ2 (aq) + 2 FeCℓ3 (aq) → SnCℓ4 (aq) + 2 FeCℓ2 (aq)
Sobre essa reação, na direção da formação dos produtos, tem-se que
Dado
Eº (Fe3+/Fe2+) = +0,77 V
Eº (Sn4+/Sn2+) = +0,15 V
Dados: Massa atômica (g/mol): Cu = 63,5
Constante de Faraday = 96500 C/mol (Coulombs por mol de elétrons)
Reação no cátodo: Cu2+ (aq) + 2 e− → Cu(s)