Questões de Concurso
Comentadas sobre eletroquímica: oxirredução, potenciais padrão de redução, pilha, eletrólise e leis de faraday. em química
Foram encontradas 305 questões
Basicamente, uma pilha eletroquímica tem os componentes mencionados a seguir, que apresentam as seguintes características:
As lacunas desse texto são, correta e respectivamente, preenchidas por:
Os experimentos de Alessandro Volta impulsionaram o estudo das pilhas, tendo ele montado a primeira pilha voltaica.
Na reação de oxirredução representada pela equação não balanceada acima, o número de oxidação médio do.
Com respeito a essa propriedade, o(a)
Considerando o valor da constante de Faraday igual a 96.500 C, e que essa é a quantidade de carga elétrica de 1 mol de elétrons, qual é a quantidade máxima, em gramas, de sódio metálico que se forma, com a carga elétrica de 386.000 C, na eletrólise ígnea do NaCl?
Dado
M(Na) = 23 g/mol
I. NH3(aq)+ H2O(l)→ NH4+(aq)+ OH¯(aq)
II. Fe2O3(s)+ 2Al(s) → 2Fe(l) + Al2O3(s)
III. 2K(s) + 2H2O(l) → 2KOH(aq)+ H 2(g)
IV. 2H2S(g)+ 4Ag(s) + O2(g)→ 2Ag2S(s)+ 2H2O(l)
São reações de oxidação-redução:
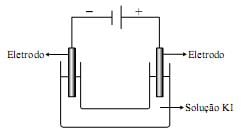
2 H2 O ( l ) + 2 I – (aq) ? H2 ( g ) + I 2 (s) + 2OH– (aq)
Com base nessas informações, afirma-se que na eletrólise de iodeto de potássio aquoso
H2S + l2 → S + 2 Hl,
as variações dos números de oxidação do enxofre e do iodo são, respectivamente:
A corrosão química somente ocorre em meio aquoso, uma vez que há transferência de elétrons no meio.
A corrosão eletroquímica é um processo espontâneo no qual acontecem, simultaneamente, reações anódicas e catódicas.
A corrosão química ocorre apenas em metais.
K2Cr2O7(aq) + SnCl2(aq) + HCl(aq) → CrCl(aq) + SnCl4(aq) + KCl(aq) +H2O(l)
Nessa reação, o
Considerando-se que a reação tenha um rendimento de 100 %, a quantidade de matéria de íons Fe2+, em mol, necessária para consumir 1,0 mol de permanganato é de
A soma dos coeficientes da reação química acima, ajustados pelo método de oxirredução, é
seguem.
seguem.