Questões de Concurso
Comentadas sobre equilíbrio químico em química
Foram encontradas 933 questões
Se 25.0 mL de uma solução de NaOH requerem 30.0 mL de HCl a 0.1 M para atingir o ponto de equivalência, qual é a concentração do hidróxido de sódio?
Uma amostra de uma solução desconhecida foi analisada e os seguintes dados foram obtidos: concentração de íons H+ = 1 x 10-4 M e concentração de íons OH- =1 x 10-10. Com base nesses dados, qual das seguintes conclusões é mais adequada?
Uma empresa de vinagre teve seus produtos adulterados com ácido clorídrico. Para determinar a concentração do ácido clorídrico na amostra de vinagre adulterado, utilizando potenciometria, um analista titulou a amostra com hidróxido de sódio. A partir do que se observa durante a titulação potenciométrica da mistura dos ácidos, analise as assertivas a seguir e assinale V, se verdadeiras, ou F, se falsas.
( ) Na mistura de ácidos, titula-se primeiro o ácido fraco, ácido acético, e depois o ácido forte, ácido clorídrico.
( ) No início da titulação, a concentração de ácido acético está reprimida e não é analisada.
( ) Uma maneira de obter os volumes de titulante gasto para a titulação potenciométrica da mistura é utilizar a 1ª e 2ª derivadas da curva potenciométrica.
( ) É possível determinar cada um dos componentes de uma mistura contendo um ácido forte e um fraco, desde que a constante de dissociação do ácido fraco seja algo maior que 10-4 e que as concentrações dos dois tenham uma diferença de até duas ordens de grandeza.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Considere a reação entre 10 mL de NH3 (0,01 mol/L) e 20 mL de HCl. Qual é o valor da concentração de íons H+ na solução? Dados Ka NH4+: 5,7.10-10.
Calcule a solubilidade molar do BaSO4 presente em uma solução de K2SO4 0,0108 mol/L. Dado Kps do BaSO4: 1,1.10-10.
A análise das características químicas da água é essencial para garantir sua qualidade em aplicações laboratoriais. Considerando parâmetros como acidez, pH, alcalinidade, alumínio, ferro e manganês, cloretos, fluoreto, sulfetos e sulfatos, sólidos dissolvidos, sólidos em suspensão, nitritos e nitratos, qual das alternativas a seguir descreve corretamente o impacto dessas características na qualidade da água?
Em uma titulação ácido-base, qual dos seguintes fatores é mais crucial para garantir a precisão e a exatidão dos resultados obtidos?
A preparação correta de soluções, tampões, indicadores e padrões é essencial para garantir a precisão das análises laboratoriais. Sobre o assunto, analise as assertivas a seguir e assinale V, se verdadeiras, ou F, se falsas.
( ) Um padrão primário deve ser altamente solúvel em água, estável e ter uma pureza elevada.
( ) Soluções tampão são preparadas utilizando pares ácido-base conjugados e são utilizadas para manter o pH constante em um intervalo específico.
( ) Soluções tampão são utilizadas para manter o pH constante, mas são ineficazes quando pequenas quantidades de ácido ou base são adicionadas.
( ) Indicadores são substâncias que mudam de cor em resposta a alterações no pH e são usados para identificar pontos de equivalência em titulações ácido-base.
( ) A concentração de uma solução padrão não precisa ser conhecida com alta precisão, pois pequenos erros não afetam os resultados analíticos.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Foi solicitado auxílio a um laboratorista para o desenvolvimento de um método analítico relacionado à análise de alguns analitos em recursos hídricos. Sabendo-se que a amostragem é uma importante etapa de desenvolvimento de métodos analíticos, é CORRETO afirmar que:
A padronização ácido-base é um procedimento essencial em laboratórios químicos para determinar a concentração exata de uma solução ácida ou básica. Um exemplo comum desse processo envolve a padronização do ácido clorídrico (HCl) e do hidróxido de sódio (NaOH). Inicialmente, uma solução de concentração conhecida de NaOH é utilizada para neutralizar uma solução de HCl, com o auxílio de um indicador apropriado, como a fenolftaleína. A partir da quantidade de NaOH consumida para neutralizar o HCl, é possível calcular a concentração exata do ácido clorídrico. A padronização ácido-base com HCl e NaOH é crucial para garantir a precisão e confiabilidade das análises químicas que dependem dessas soluções.
Suponha que você tenha um NaOH 0,25 molar e gastou 6 mL para titular o HCl com concentração de 0,1 molar. Qual o volume de HCl que continha no Erlenmeyer? Assinale a alternativa CORRETA.
Analise as alternativas a seguir.
I. Copo com álcool hidratado.
II. Copo com água e gelo.
III. Copo de água com gás.
O sistema heterogêneo com duas fases é observado apenas em:
Leia o texto para responder às questões de 32 a 34. Ao ser contratado, o técnico observou que foram acumulados, no laboratório, vários frascos com resíduos químicos que devem ser tratados e/ou encaminhados para descarte correto. Consultando uma central de resíduos já estabelecida, ele encontrou algumas informações que poderiam auxiliar nesse processo. Por exemplo, soluções aquosas de sais inorgânicos de metais alcalinos e alcalinos terrosos: NaCl, KCl, CaCl2, MgCl2, Na2SO4, MgSO4 e tampões PO43-, não contaminados com outros produtos, devem ser diluídos e descartados diretamente na rede de esgoto. Soluções de ácidos ou bases inorgânicas: H2SO4, HCl, H3PO4, HNO3, KOH, NaOH, Na2CO3, K2CO3, NaHCO3, KHCO3. devem ser diluídas e neutralizadas, podendo, então, serem desprezadas na rede de esgoto, desde que não contaminadas com outros produtos.
A primeira etapa foi a identificação dos frascos buscando segregar os resíduos que são passíveis de destruição /neutralização no próprio laboratório, para posterior descarte na pia. Três frascos foram separados, pois se enquadravam nessa situação. Eles estavam classificados como descrito abaixo:
Frasco | Quantidade | Composição sugerida |
1 | 9,6L | Resíduo da reação de H2SO412 mol L-1 com Magnésio metálico e água de lavagem. |
2 | 12,4L | Solução de Bicarbonato de sódio (NaHCO3) e Ácido clorídrico (HCl). |
3 | 11,2L | Resíduo de KOH 6 mol L-1 com água de lavagem. |
Prezando pela segurança, este técnico buscou confirmar o máximo de informações apresentadas nesses rótulos, antes de proceder a qualquer tratamento. Assim, ele realizou alguns ensaios com amostras dos resíduos de forma a verificar aspecto físico, coloração, presença de precipitados, pH e ainda testes qualitativos para íons.
Disponível em: <https://www.sgas.ufscar.br/degr/residuos/residuos-quimicos/tratamento-no-laboratorio> (Com adaptações). Acesso em: 17. Abr. 2024.
Uma das propriedades relevantes dessas soluções que deve ser confirmada é o pH, que indicaria se a solução é ácida, neutra ou básica, como se espera para os frascos 1, 2 e 3, respectivamente. Essa medida de acidez e basicidade pode ser feita, qualitativa ou quantitativamente, no laboratório de Química usando diferentes equipamentos, vidrarias e/ou reagentes.
Das alternativas abaixo, qual apresenta as três possibilidades adequadas para estimar o pH das soluções?
Mercúrio (e seus compostos) é um tipo de contaminante que, em hipótese alguma, pode ser descartado na rede de esgoto, dado seu potencial tóxico e cumulativo. Contudo, sem ter como recuperar esse metal de um galão com 5 litros de resíduo de sais de mercúrio (I), o técnico do laboratório de Química Geral optou por reduzir o volume para encaminhar uma quantidade menor ao descarte. Para evitar riscos ou gasto de energia, ele optou pela técnica de precipitação. Consultando a tabela disponível nos manuais e na internet, ele encontrou as seguintes opções para a constante de produto de solubilidade (Kps) dos sais de mercúrio:
|
Fórmula do sal que será formado |
Kps |
Hg2Cl2 |
1,5x10-18 |
HgI2 |
2,8x10-19 |
Hg2(SCN)2 |
3,1x10-20 |
Hg2Br2 |
6,4x10-23 |
Hg(OH)2 |
3,1x10-26 |
Hg2I2 |
5,3x10-29 |
HgS |
1,6×10-54 |
Com base na tabela, qual contra-íon o técnico deve usar para que a precipitação do resíduo que ele possui seja máxima?
Leia o texto a seguir para responder às questões de 21 a 23.
Alfenas está situada no Sul de Minas, às margens do Lago de Furnas, um dos maiores lagos artificiais do Brasil. Embora o objetivo inicial da construção desse lago tenha sido a geração de energia a partir da construção de uma usina hidrelétrica, ao longo destes 60 anos as atividades turísticas e recreativas se intensificaram nessa região e não é mais possível imaginá-la sem visitantes. Contudo, recentemente uma reportagem trouxe uma preocupação para a região. Um estudo da UFMG indicou que atividades humanas como a agricultura, pecuária e lançamento do esgoto in natura podem ter afetado a qualidade da água do Lago de Furnas. Em suas análises, a pesquisadora considerou dados oficiais de monitoramento das águas em Minas Gerais relativos às bacias que alimentam o Lago de Furnas, considerando os parâmetros de turbidez, pH, densidade de cianobactérias e os níveis de E. coli.
Quando nos referimos a contaminantes inorgânicos, como cromo, mercúrio, chumbo ou cadmio, a presença destes em fontes hídricas ou até mesmo nos peixes que ocupam essas fontes é comum, dadas as atividades cotidianas ou industriais que ocorrem nos municípios ao redor. E outra atividade frequente na região de Furnas refere-se à pesca esportiva ou como fonte de renda, com criação especialmente de tilápias em tanques. Embora não tenha sido apontado no estudo, o monitoramento constante dos níveis de contaminantes, sobretudo os inorgânicos, nas águas do lago, é crucial para garantir a qualidade do peixe que chega à mesa dos mineiros e seus visitantes.
Disponível em: <https://ufmg.br/comunicacao/noticias/presenca-de-contaminantes-fecais-no-lago-de-furnas-pode-estar-acima-do-permitido> (Com adaptações). Acesso em: 17 abr. 2024.
No estudo realizado na UFMG, é mencionado que uma das análises feitas foi do pH das amostras de água do lago. O pH é uma escala bastante útil em Química já que a concentração dos íons hidrônio [H3O+] pode variar em várias ordens de grandezas. Assim, evitando uma faixa extensa de valores, o pH é expresso em termos do logaritmo negativo (na base 10) da concentração dos íons hidrônio, em mol por litro, ou seja, pH = - log [H3O+]. Contudo, essa definição é uma simplificação que se aplica às soluções suficientemente diluídas, já que o pH dessas soluções é medido orginalmente com base na ___________ dos íons H3O+.
Assinale a alternativa que completa corretamente a lacuna do texto:
O detergente neutro é um produto químico de limpeza responsável pela higienização mais básica das superfícies e utensílios. O fato de ser neutro significa que o valor do seu pH é de:
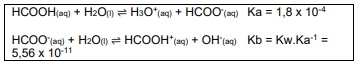
Calcule a concentração de íons hidrônio de uma solução tampão obtida pela mistura das soluções ácido fórmico 0,25 mol L-1 e formiato de sódio 0,9 mol L-1.
Em relação a esse fato, os valores de pH e pOH representam um modo de exprimir a [H+] de uma solução aquosa e, indiretamente, expressar também sua [OH-]. Assim, sabendo-se que uma pessoa diluiu 40.0 mL de seu suco gástrico (solução contendo ácido clorídrico), de pH = 1.0, ao tomar dois copos de água, levando a solução resultante a apresentar um volume final de 400.0 mL, caracterizando uma diluição, o pH da solução resultante logo após a ingestão da água será: