Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
[PCl5 ] 0,0456 Mol. L-1 [PCl3 ] 0,0211 Mol. L-1 [Cl2 ] 0,0121 Mol. L-1
Calcule o valor da constante de equilíbrio (em termos da concentração) em 170°C.
“Tomar água com pH (potencial de hidrogênio) menor que 7,4 pode acelerar o processo de envelhecimento. Quem defende essa ideia é o cardiologista e nutrólogo brasileiro Lair Ribeiro.
Ele explica que o pH do nosso sangue é aproximadamente 7,4. Quando você consome alguma coisa de pH diferente disso, o corpo tem que trabalhar para equilibrar esse líquido.
A conclusão é que, tomando uma água de pH menor que o do sangue, você acelera seu processo de envelhecimento. Para quem já esqueceu a aula de química, vale lembrar: pH igual a 7 é neutro.”
De acordo com esse trecho da reportagem se em um laboratório uma amostra de água apresentar uma concentração molar de íons H3O + =4,0 x10-8 mol.L-1 . Qual seria o pH dessa água?
O indicador ácido-base azul de bromotimol apresenta as seguintes características em solução aquosa:
pH 1 cor amarela
pH 7 cor verde
pH 12 cor azul
Em um laboratório químico foram adicionadas gotas do indicador azul de bromotimol em cada um dos três tubos de ensaio identificados na figura.
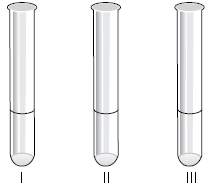
I. Soro fisiológico (solução aquosa de sal de cozinha e açúcar).
II. Solução aquosa de hidróxido de sódio.
III. Solução aquosa de ácido clorídrico.
É correto afirmar que as soluções dos tubos I, II e III apresentaram, respectivamente, as colorações:
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
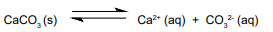
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
Uma titulação entre uma base fraca e um ácido forte apresenta a curva de pH abaixo, onde S é o ponto estequiométrico (também chamado de ponto de equivalência).
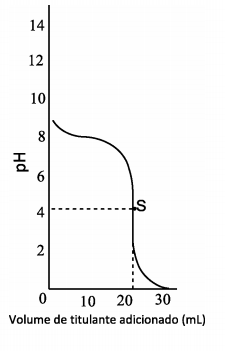
Sabendo que log 2 = 0,3 e considerando as opções apresentadas, o indicador mais eficiente para esta titulação é:
Para determinar a concentração de íons iodeto em 200 mL de uma solução, foi adicionado bromo, a fim de converter iodeto em iodato, de acordo com a reação:

Posteriormente, o íon iodato foi precipitado como iodato de bário, através da adição de íons bário:
Sabendo que se obteve, ao final do processo, 0,974 g de iodato de bário, calcule a concentração de iodeto na solução em
g/L. Massas molares (g/mol): O = 16; I = 127; Ba = 137.
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
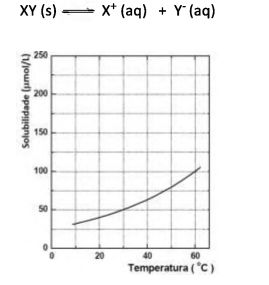
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?
Os dados da literatura científica mostram que K = 54, em 700 K, para a reação:

Considere uma mistura de hidrogênio, iodo e gás iodídrico em 700 K, cujas pressões parciais dos gases sejam 10 bar, 8
bar e 1 bar, respectivamente. Sobre essa mistura reacional e os valores do quociente de reação (Q) e da constante de
equilíbrio (K), é correto afirmar que:
Os oceanos possuem a capacidade de absorver certas quantidades de CO2 atmosférico através dos equilíbrios que
formam o denominado sistema carbonato:
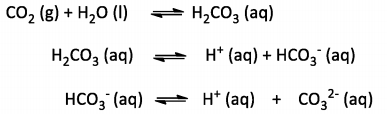
A concentração de cada espécie do sistema carbonato varia, dependendo do pH do meio. Considerando um experimento
em laboratório que simula uma condição de extrema alcalinidade (pH = 14), a espécie do sistema carbonato em maior
concentração será
Em um laboratório de oceanografia química, um técnico analisou uma amostra de água de um canal e percebeu elevada turbidez. Acerca dessa característica, considere as afirmativas a seguir.
1) Deve-se à presença de íons em solução, como sódio e nitrato (Na+ e NO3").
2) É causada pela presença de partículas em suspensão que podem ter origem orgânica ou inorgânica.
3) Pode ser medida em laboratório utilizando-se um turbidímetro.
Está(ão) correta(s), apenas:
Para a realização de uma análise, é necessário o preparo
de uma solução tampão básica. Estão disponíveis os seguintes reagentes:
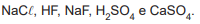
Os reagentes a serem selecionados para o preparo da solução tampão são:
Em um experimento, avaliou-se a seguinte reação química:

As concentrações iniciais de SO2 e O2 foram 0,3 mol/L e 0,2 mol/L, respectivamente. No início da reação, não havia SO3 no reator, mas atingido o equilíbrio, sua concentração foi igual a 0,2 mol/L.
Para esse sistema, a constante de equilíbrio, em termos
de concentrações, é igual a
Em um laboratório, estão disponíveis os seguintes sais:
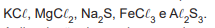
A dissolução de um desses sais em água acarretou a formação de uma solução aquosa com pH ácido.
O sal dissolvido correspondeu a