Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
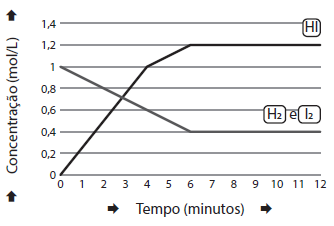
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
Julgue o item, relativos a ácidos e bases.
A solução‐tampão é aquela cujo pH é mantido constante quando pequenas quantidades de ácido ou base são adicionadas. Um tampão básico, que estabiliza soluções em pH > 7, é preparado com uma solução que contém CH3COOH e CH3CO2− .Julgue o item, relativos a ácidos e bases.
Indicadores ácido‐base são comumente utilizados nas
titulações de ácidos e bases, sejam fracos ou fortes. O
indicador é um ácido ou uma base cujas espécies
protonadas (ou desprotonadas) têm cores diferentes.
Em solução aquosa, o comportamento de um indicador
depende essencialmente do valor de pH.
Julgue o item, relativos a ácidos e bases.
Os ácidos fracos em solução aquosa não são
completamente dissociados, mas os ácidos com
constante de acidez (Ka) menor que 1 são
completamente dissociados para todas as
concentrações e podem ser considerados como ácidos
fortes.
Julgue o item, relativos a ácidos e bases.
Um ácido forte se ioniza completamente em água, o que
dá origem ao ácido conjugado do solvente, o íon H3O+
(ou simplesmente H+
). As bases fortes são compostos
iônicos no estado sólido e a dissolução em água envolve
a separação dos íons preexistentes.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
As expressões da constante de equilíbrio são muito
importantes porque permitem que os químicos possam
prever a direção e a extensão de uma reação química.
Contudo, uma expressão da constante de equilíbrio não
fornece informações relacionadas à velocidade na qual
o equilíbrio é alcançado.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
Pelo princípio de Le Chatelier, quando se exerce uma
ação sobre um sistema em equilíbrio dinâmico, ele se
desloca no sentido que produz uma minimização da ação
exercida. Em outras palavras, sempre que se aplicar um
esforço sobre um sistema em equilíbrio, a posição de
equilíbrio será alterada na direção que tende a
minimizar ou anular o efeito do esforço aplicado.
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
O carbonato de cálcio, presente no calcário, reage com o íon hidrônio, formando íons bicarbonato em água, conforme mostrado na equação seguinte.
CaCO3 (s) + H3O+ (aq) <=> HCO3 -(aq) + Ca2+ (aq) + H2O (l)
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
A correção da acidez do solo pode ser realizada com a
aplicação de calcário (calagem) e tem como objetivo
ajustar o pH do solo.
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Cavernas de calcário são formadas pela ação de dissolução das rochas calcárias pela água subterrânea, que contém dióxido de carbono, conforme a equação química a seguir.
CaCO2 (s) + H2O + CO (aq) --> Ca(HCO2)2 (aq)
Com relação a esta temática, classifique os itens abaixo como Verdadeiros (V) ou Falsos (F):
( ) O pH é medido em uma escala de 0 a 14 e dependendo do valor é considerado ácido, neutro ou básico (também chamado de alcalino). ( ) Os ácidos são os mais próximos do 14. ( ) Os alcalinos são os mais próximos do 0. ( ) Os neutros são os com pH 7 ou aproximado a este valor. ( ) No sistema de distribuição de água, a portaria 2914 do Ministério da Saúde determina que o pH fique entre 6 e 9,5.
Assinale a sequência CORRETA:
[H2]=1,83x10-3 mol/L, [l2]= 3, 12x10-3 mol/L e [HI]= 17,67 X 10-3 mol/L. 2 HI(g)
 H2(g) + I2(g)
H2(g) + I2(g)O Ca(OH)2 é ____________, ou seja, em solução aquosa está ____________.
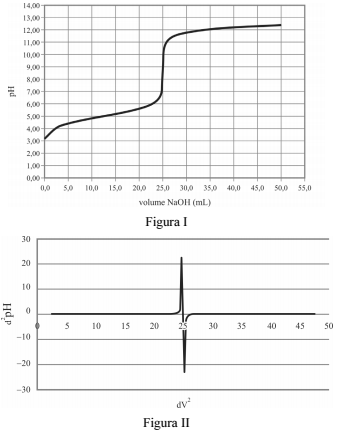
A figura I precedente mostra a variação do pH em função do volume de NaOH na titulação de 50,0 mL de uma solução de um ácido com uma solução de NaOH a 0,05 mol/L. A figura II mostra a segunda derivada da curva da figura I.
Considerando essas informações, assinale a opção correta a respeito
de volumetria e dos assuntos que esse tema suscita.
Texto 19A1BBB
Um caminhão contendo ácido sulfúrico (H2SO4) concentrado tombou e seu conteúdo vazou sobre a rodovia e atingiu um pequeno lago nas imediações. Nos dias que se seguiram ao acidente, a análise da água do lago detectou uma concentração analítica do ácido igual a 1,00 • 10 2 mol/L. Visando-se a neutralizar a acidez causada na água do lago, um produto químico foi utilizado.
Para responder à questão, considere que a solução formada tenha comportamento ideal, que inicialmente a água se encontrava com pH neutro, que a primeira ionização do ácido sulfúrico seja completa e a segunda ionização seja parcial, e assuma 0,30 como o valor de log 2.
Texto 19A1BBB
Um caminhão contendo ácido sulfúrico (H2SO4) concentrado tombou e seu conteúdo vazou sobre a rodovia e atingiu um pequeno lago nas imediações. Nos dias que se seguiram ao acidente, a análise da água do lago detectou uma concentração analítica do ácido igual a 1,00 • 10 2 mol/L. Visando-se a neutralizar a acidez causada na água do lago, um produto químico foi utilizado.
Para responder à questão, considere que a solução formada tenha comportamento ideal, que inicialmente a água se encontrava com pH neutro, que a primeira ionização do ácido sulfúrico seja completa e a segunda ionização seja parcial, e assuma 0,30 como o valor de log 2.
É comum, nos laboratórios químicos, efetuar a mistura de duas (ou mais) soluções de um mesmo soluto, ou a mistura de soluções cujos solutos reagem entre si. A respeito desse assunto e os cálculos relacionados, julgue o item a seguir.
A mistura das soluções de NH4
Cl e NaOH,
em proporções iguais, consiste em uma
solução tampão.
Como acontece com todas as ionizações, a água também se ioniza em um processo reversível até atingir um estado de equilíbrio, denominado equilíbrio iônico da água. A respeito dos conceitos do produto iônico da água e de pH e pOH, julgue o item a seguir. Dado: Kw = 1,0x10-14.
Em uma solução aquosa de ácido acético
0,1 mol/L que está 1,0% ionizado, o pH
dessa solução é igual a 3,0.
Como acontece com todas as ionizações, a água também se ioniza em um processo reversível até atingir um estado de equilíbrio, denominado equilíbrio iônico da água. A respeito dos conceitos do produto iônico da água e de pH e pOH, julgue o item a seguir. Dado: Kw = 1,0x10-14.
Uma solução aquosa que apresenta
concentração hidroxiliônica igual a
10-6 mol/L possui pH ácido.