Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.180 questões
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores. II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo. III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade. IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações. V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta:
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
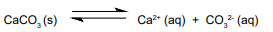
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
A seguir, uma curva típica de pH em função do volume adicionado para uma titulação.
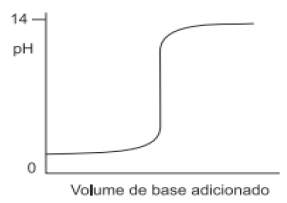
Observando essa curva, assinale a alternativa que apresenta, respectivamente:
I. O pH de viragem para uma titulação ácido forte-base forte completa (o ponto de equivalência); II. O titulante utilizado (ácido/básico).
Nesse contexto, os analisadores de pH
Uma titulação entre uma base fraca e um ácido forte apresenta a curva de pH abaixo, onde S é o ponto estequiométrico (também chamado de ponto de equivalência).
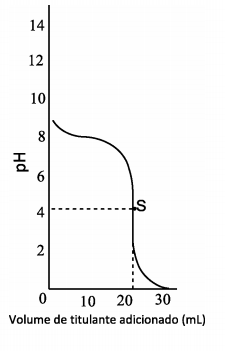
Sabendo que log 2 = 0,3 e considerando as opções apresentadas, o indicador mais eficiente para esta titulação é:
Para determinar a concentração de íons iodeto em 200 mL de uma solução, foi adicionado bromo, a fim de converter iodeto em iodato, de acordo com a reação:

Posteriormente, o íon iodato foi precipitado como iodato de bário, através da adição de íons bário:
Sabendo que se obteve, ao final do processo, 0,974 g de iodato de bário, calcule a concentração de iodeto na solução em
g/L. Massas molares (g/mol): O = 16; I = 127; Ba = 137.
Considere os ácidos abaixo

Um estudante prepara soluções aquosas desses ácidos com a mesma concentração molar. Sobre esses ácidos e as
espécies presentes nas soluções, é correto afirmar que:
Observe abaixo a representação do equilíbrio e da curva de solubilidade (em pmol/L) de um sal hipotético XY:
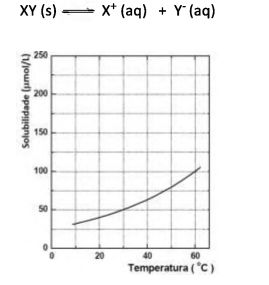
Qual é a constante do equilíbrio de solubilidade (Kps) do sal XY em 60 ºC?
Os dados da literatura científica mostram que K = 54, em 700 K, para a reação:

Considere uma mistura de hidrogênio, iodo e gás iodídrico em 700 K, cujas pressões parciais dos gases sejam 10 bar, 8
bar e 1 bar, respectivamente. Sobre essa mistura reacional e os valores do quociente de reação (Q) e da constante de
equilíbrio (K), é correto afirmar que:
Os oceanos possuem a capacidade de absorver certas quantidades de CO2 atmosférico através dos equilíbrios que
formam o denominado sistema carbonato:
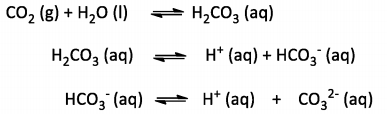
A concentração de cada espécie do sistema carbonato varia, dependendo do pH do meio. Considerando um experimento
em laboratório que simula uma condição de extrema alcalinidade (pH = 14), a espécie do sistema carbonato em maior
concentração será

