Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.163 questões
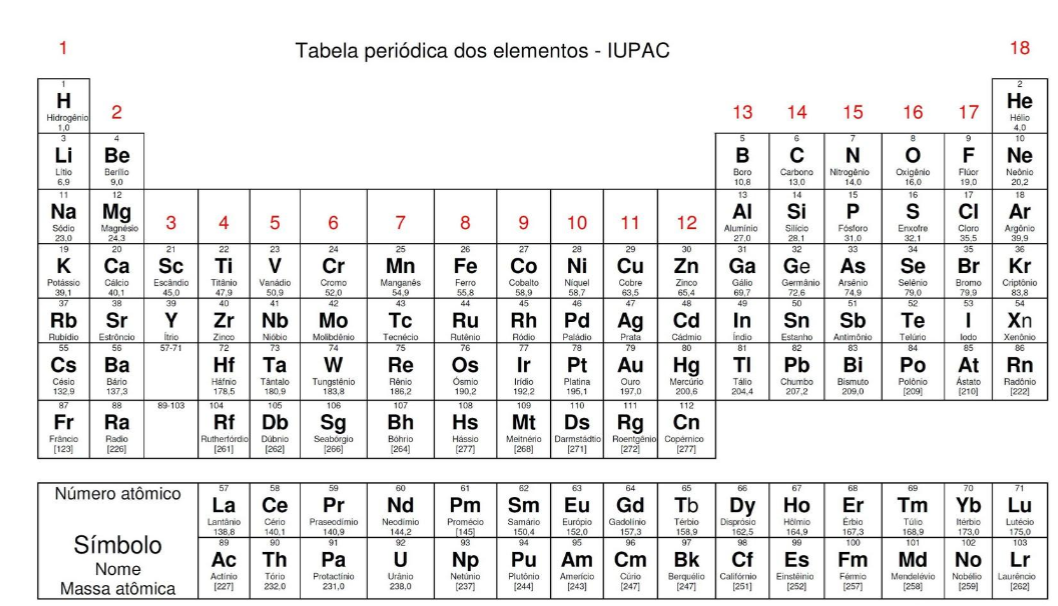
A tabela a seguir contém os valores das constantes de equilíbrio de alguns ácidos e bases.
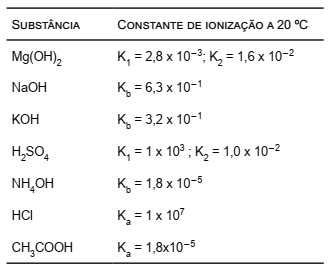
Uma das reações de identificação dos íons magnésio consiste em precipitá-lo com base forte, formando o hidróxido de magnésio, branco, segundo a equação:
Mg2+ (aq) + 2OH–(aq)  Mg(OH)2
(s)
Mg(OH)2
(s)
O precipitado formado pode ser dissolvido quando ao
meio aquoso é adicionado o sal
A fenolftaleína é um indicador ácido-base cuja faixa de viragem está descrita abaixo.
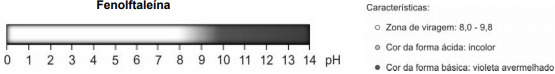
Espera-se observar a cor avermelhada ao colocar a fenolftaleína na solução resultante da mistura de água com
I. cloreto de amônio.
II. sódio metálico.
III. carbonato de sódio.
IV. sal de cozinha.
Está correto o que se afirma em
Considere abaixo o equilíbrio químico.
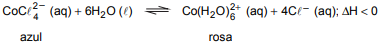
Em uma solução de cor rosa, espera-se observar a cor azul quando:
I. For adicionada solução de ácido clorídrico.
II. O sistema for aquecido.
III. Ao diluir a solução com água.
Está correto o que se afirma APENAS em
A variação de pH de uma solução em relação ao volume de titulante adicionado pode ser observada nas curvas de titulação a seguir.
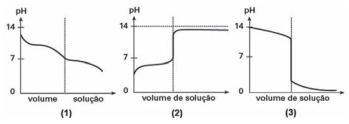
Assinale a alternativa correta.
Qual será o valor do pH de uma solução a 0,10mol.L-1 de cloreto de amônio, a 25°C:
(Dados: Kb = 2x10-5 , Kw = 1x10-14 , Log7 = 0,85)
Assinale a alternativa que contem o valor aproximado do pH de um tampão de ácido benzóico (C6H5CO2H) e benzoato de sódio (NaC6H5CO2) de concentrações iguais a 0,1 mol.L-1 e 0,5 mol.L-1 , respectivamente: (Dados: Ka do ácido benzóico = 6,3x10-5 ; Log 6,3 = 0,80)
Considerando-se o pH de uma solução de uma substância X com concentração de 4,6 x 10-3 mol/L, um aluno classificou corretamente, tal solução como:
A 25ºC, o pH de uma solução de [OH- ] = 2,0 x 10-3 mol/L é:
(Sugestão: use log 2 = 0,30)
O pH da maior parte das águas naturais contendo organismos vivos está entre 6,5 e 8,5. Para níveis de pH abaixo de 4,0, todos os vertebrados, a maioria dos invertebrados e muitos microrganismos são destruídos. Os lagos mais suscetíveis ao estrago são os de baixas concentrações de íons básicos, como HCO3 - , que os tamponam contra variações de pH. Mais de 300 lagos no estado de Nova York não contêm peixes e 140 lagos em Ontário, Canadá, são destituídos de vida. A chuva ácida que parece ter matado os organismos nesses lagos origina-se a centenas de quilômetros no sentido contrário ao vento nas regiões do Vale de Ohio e dos Grandes Lagos. Fonte: BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.p.660.
Com relação aos efeitos sobre o ecossistema, analise as afirmativas:
I. Como os ácidos reagem com os metais e com os carbonatos, a chuva ácida é corrosiva
tanto para metais quanto para materiais de construção em pedra.
II. A acidez tem afetado muitos lagos no norte da Europa, dos Estados Unidos e do Canadá, reduzindo as populações de peixes, bem como afetando outras partes do ecossistema dentro dos lagos e nas florestas das redondezas.
III.O dióxido de enxofre por si só é prejudicial tanto à saúde humana quanto à propriedade; além disso, SO2 atmosférico pode ser oxidado a SO3 por quaisquer dos vários diferentes caminhos e este, se dissolve na água, produzindo ácido sulfúrico, causando efeitos ambientais desastrosos; constituindo o “maior vilão” da chuva ácida.
A alternativa que indica, apenas afirmação (ões) verdadeira(s) é:
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas
A química ácido-base de muitos sistemas de águas naturais, que inclui rios e lagos, é dominada pela interação do íon carbonato com o ácido carbônico, sendo o equilíbrio entre as espécies dependente do pH do meio. No gráfico abaixo, as espécies predominantes no sistema carbonato estão representadas por números 1, 2 e 3. Observando o gráfico, assinale a alternativa que correlaciona a numeração com a espécie, respectivamente.
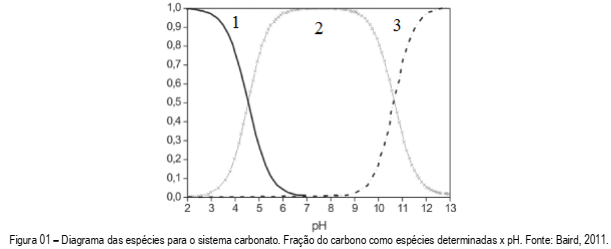
O denominado potencial hidrogeniônico (pH) ou índice de Sorensen é usado para realizar a medida da concentração de íons H+ . O valor do pH para uma solução de HCl 0,5M, cujo grau de ionização é de 80%, é de:
Dado: log 2 = 0,3.
2g de uma mistura de sulfato de sódio e cloreto de potássio são tratados pelo nitrato de bário, obtendo-se um precipitado branco, que em seguida é lavado e seco e pesou 1,165g. A composição centesimal da mistura é:
Dados: Ba=137,33; Na=23,0; S=32,0; N=14,0; Cl=35,5 e K=39,0