Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.173 questões
Considere a reação ácido-base entre amônia e água mostrada a seguir:
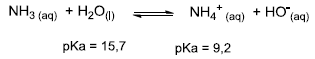
( ) A constante de basicidade da reação será Kb = [NH4+ ][HO- ]/[NH3]. ( ) A adição de NH4Cl deslocará o equilíbrio no sentido dos produtos. ( ) A água é um ácido mais fraco do que o íon amônio (NH4+ ), e o equilíbrio está deslocado no sentido dos reagentes. ( ) A amônia (NH3) é uma base mais forte do que o íon hidróxido, e o equilíbrio da reação está deslocado no sentido dos reagentes.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
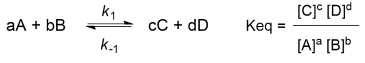
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1. as concentrações de A, B, C e D são iguais. 2. as concentrações de A, B, C e D não se alteram com o tempo. 3. a reação para de acontecer, logo, a formação de produtos é interrompida. 4. a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
Com base nessa situação hipotética, assinale a alternativa que apresenta o valor do pH da solução formada após a realização da mistura.
Texto para a questão.
Curvas de solubilidade em água em função da temperatura para algumas substâncias

A adição de NH3(aq) a uma solução saturada de cloreto de prata em contato com o precipitado resultará
2SO3(g)
 2SO2(g) + O2(g).
2SO2(g) + O2(g).
Inicialmente a pressão parcial do trióxido de enxofre era de 1,6 bar. Ao atingir o equilíbrio foi constatada uma porcentagem de decomposição de 60%.
Se a esse sistema em equilíbrio for adicionado 1 mmol de dióxido de enxofre, mantendo-se constante as condições anteriores, quando o novo equilíbrio for atingido,
Assinale a opção que indica o par que pode ser utilizado para o preparo de um tampão básico.
Considere um tubo selado contendo inicialmente N2O4 com pressão parcial de 0,45 atm. e temperatura constante. Após o equilíbrio ser atingido, a pressão parcial determinada para o N2O4 foi de 0,08 atm.
Com base nesses dados experimentais, o valor aproximado da constante de equilíbrio em função das pressões parciais dos gases envolvidos, é de
Responsável pelo abastecimento de 12 milhões de pessoas na Região Metropolitana do Rio (80% da população), o Rio Paraíba do Sul está na iminência de uma catástrofe em Volta Redonda, no Sul Fluminense. O alerta consta na denúncia 1518/18, aceita pelo Ministério Público Federal, que abriu inquérito para apurar responsabilidades (...) A ação adverte para o risco de deslizamento de uma pilha gigante, sem contenção, de escória. Adaptado de https://odia.ig.com.br/rio-de-janeiro/2018 Acesso em 18/06/2018
A pilha de escória contém areia, cal virgem, enxofre e metais tóxicos como manganês, zinco, cádmio, crômio, níquel e chumbo e corre o risco de escorregar com a ação das chuvas e contaminar o rio Paraíba do Sul e os lençóis freáticos.
Assinale a opção que indica o problema ambiental que esta contaminação pode causar ao ambiente aquático.
A fim de testar as propriedades da água, Breno a aqueceu em uma panela e, antes de atingir seu ponto de ebulição, retirou a panela do fogo. Em seguida, ele recolheu parte dessa água com uma seringa, tapou a ponta dela e puxou o êmbolo. O que Breno observou, na sequência, foi que a água, dentro da seringa, entrou em ebulição a uma temperatura abaixo de 100 ºC.
A água entrou em ebulição com o deslocamento do êmbolo, pois este deslocamento
Observe a tabela de solubilidade abaixo.
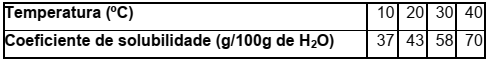
Em uma solução, preparada em um laboratório, foram dissolvidas 27 gramas de soluto em 100
gramas de água, à temperatura de 20 °C. Essa solução será
Determine o pH aproximado de uma solução tampão preparada pela adição de 14,5 g de bicarbonato de sódio e 9 g de carbonato de sódio em água suficiente para completar 500 mL de solução.
(Dados: pKa do ácido é 10,32 ; log 2 = 0,3 ; log1/2 = ‒0,3.)
Na titulação de dois sucos de laranja com hidróxido de sódio, NaOH, 0,10 mol.L−1 foram obtidos os resultados abaixo.

Considerando apenas o ácido cítrico, um ácido triprótico, conclui-se que a laranja pera é