Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
A = 0,1 g B = 0,5 g C = 2,5 g D = 7,5 g
Com base na solubilidade do sal, a 25°C, que é igual a 7,06 g /100 mL de água, em qual(is) tubo(s) o permanganato de potássio estará totalmente dissolvido, após agitação?
 , no qual não havia sua
concentração registrada. Para verificar a concentração dessa solução, transferiu uma alíquota de 2,00 mL da
mesma para um balão volumétrico de 25,0 mL, completando o restante com água. Em seguida, foram
transferidos 10,0 mL da solução diluída para um erlenmeyer para proceder à titulação. O volume de NaOH,
0,100 mol.L-1, gasto na titulação foi de 20,0 mL. Qual a concentração da solução de HC
, no qual não havia sua
concentração registrada. Para verificar a concentração dessa solução, transferiu uma alíquota de 2,00 mL da
mesma para um balão volumétrico de 25,0 mL, completando o restante com água. Em seguida, foram
transferidos 10,0 mL da solução diluída para um erlenmeyer para proceder à titulação. O volume de NaOH,
0,100 mol.L-1, gasto na titulação foi de 20,0 mL. Qual a concentração da solução de HC encontrada no
laboratório?
encontrada no
laboratório? Leite I: pH = 7,0 Leite II: pH = 3,0 Leite III: pOH = 11,0
Com base nas informações acima classifique os leites:
O texto a seguir foi adaptado de Quim. Nova, v. 39, 732- 740, 2016.
“Nos ambientes aquáticos, a concentração de fosfatos na coluna de água é dependente de alguns fatores, como o par redox Fe(II)/Fe(III), uma vez que nas camadas superficiais sua associação com os oxi-hidróxidos de Fe(III) formam compostos que apresentam baixa solubilidade e migram para camadas mais profundas (sedimento). Nessas camadas os oxi-hidróxidos de Fe(II), mais solúveis que os compostos de Fe(III, são formados, com a liberação do fosfato, estabelecendo um ciclo onde o fósforo migra novamente para as camadas superficiais.”
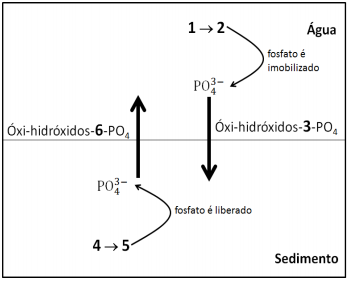
O equilíbrio químico descrito no texto evidencia que os
números 1, 2, 3, 4, 5 e 6 são:
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
Pelo princípio de Le Chatelier, quando uma força é
aplicada a um sistema em equilíbrio dinâmico, o
equilíbrio tende a se ajustar para minimizar o efeito da
força. Um exemplo disso seria o fato de que uma reação
no equilíbrio tende a seguir em uma reação endotérmica
quando se aumenta a temperatura.
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
O equilíbrio químico ocorre quando há um equilíbrio
dinâmico entre reagentes e produtos em uma reação
química, ou seja, a condição na qual os processos direto
e inverso ocorrem simultaneamente em velocidades
iguais.
A química é muito importante para a compreensão do ambiente e das transformações que nele acontecem, sejam elas naturais ou não. Com relação às transformações e aos fenômenos químicos que acontecem no ambiente, julgue o próximo item.
Uma das consequências da chuva ácida para a natureza é o fato
de que ela aumenta o pH de rios e lagos.
A química é muito importante para a compreensão do ambiente e das transformações que nele acontecem, sejam elas naturais ou não. Com relação às transformações e aos fenômenos químicos que acontecem no ambiente, julgue o próximo item.
Uma chuva cujo pH seja igual a seis é considerada chuva
ácida.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
As transformações radioativas não são consideradas reações
químicas.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A radioatividade é um fenômeno artificial inventado pelos
cientistas.