Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
Na titulação de dois sucos de laranja com hidróxido de sódio, NaOH, 0,10 mol.L−1 foram obtidos os resultados abaixo.

Considerando apenas o ácido cítrico, um ácido triprótico, conclui-se que a laranja pera é
O pH de uma solução 0,001 mol/L de NaOH a 25 °C em relação a uma solução 0,0001 mol/L da mesma substância à mesma temperatura será
Dados:
Kw = 1,0 × 10−14
Considere o sistema tampão entre ácido acético e acetato de sódio. A relação necessária entre concentração de base conjugada e seu ácido, para que o pH da solução tampão seja igual a 7 será
Dados:
pKa (ácido acético/acetato de sódio) = 4,74
Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.

A amônia atmosférica é de fundamental importância para a química ambiental, pois se trata de um composto capaz de neutralizar, em determinada extensão, gases ácidos e espécies ácidas adsorvidas em partículas.
Em uma determinada temperatura, a amônia apresenta pKb= 5. Nessas condições uma solução 0,1mol.L–1 de amônia apresentará valor de pH igual a
Dado: pKw = 14
Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g) com Kc = 4,00
A concentração, em mol.L–1 de dióxido de carbono nesse
equilíbrio é de
Íons Ba2+(aq) são altamente tóxicos e suas soluções não podem ser descartadas na rede de esgoto. Esses íons devem, portanto, ser removidos de misturas que se pretende descartar, o que pode ser feito através de reações de precipitação. Para a remoção de íons Ba2+(aq) de 1,0 L de resíduo de concentração 0,01 mol L -1 foram propostos os seguintes procedimentos:
I. Adição de 0,1 L de solução de Na2CO3 0,1 mol L-1
II. Adição de 0,1 L de solução de Na2SO4 0,1 mol L-1
III. Adição de 0,1 L de solução de Na3PO4 0,01 mol L-1
IV. Adição de 0,1 L de solução de NaOH, 0,01 mol L-1
Dado: Constante do produto de solubilidade dos compostos de bário (Ks)
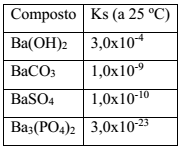
O procedimento que resulta na produção de um material mais adequado ao descarte é:
Acerca das teorias ácido-base e tampão são feitas as seguintes afirmações:
I. Segundo a teoria de Arrhenius ácidos e bases são classificados segundo sua capacidade de doar e receber prótons.
II. Quanto maior o valor da constante de ionização de uma base, maior será o valor do pH da solução.
III. Para uma solução de amônia que apresenta concentração dos íons OH- igual a 10-3 mol L-1, o pH é igual a 3.
IV. Um sistema tampão pode ser formado por um ácido forte e sua base conjugada.
V. Dobrando a concentração de ácido e sua base conjugada, que formam a solução tampão, o pH permanece constante, porém o poder tamponante aumenta.
É CORRETO o que se afirma em:
Cavernas próximas a regiões com solo rico em calcário podem formar estalactites com o passar dos anos. Sua formação pode ser representada pela equação:
CaCO3 (s) + CO2(g) + H2O (l) ⇌ Ca2+ (aq) + 2 HCO3 - (aq)
Dentre as seguintes condições:
I. Evaporação constante da água;
II. Corrente de ar frio e úmido;
III. Elevação da temperatura no interior da caverna;
IV. Visitas frequentes de grandes grupos de pessoas.
Quais favorecem a formação de estalactites?

Assinale a alternativa correta:
Devido à grande emissão de gases lançados na atmosfera, nas regiões mais populosas é evidente a ocorrência da chuva ácida. Na sua precipitação, um dos ácidos responsáveis pela acidez é o sulfúrico. Um equilíbrio envolvido na formação desse ácido na água da chuva está representado pela equação:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Considere que são colocados 6 mol de SO2, 5 mol de O2 e 4 mol de SO3 num recipiente fechado de 5,0 L para reagirem até o sistema atingir o equilíbrio a dada temperatura. A variação do número de mol dos gases participantes está registrada no gráfico.
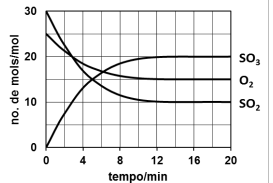
Nestas condições, a constante de equilíbrio, KC, é
igual a:
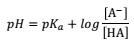
em que, o HA é o ácido e A– é a base conjugada.
Com base no exposto, identifique as afirmativas verdadeiras.
I. O pH da solução será igual ao pKa se a [A– ] for igual a [HA]
II. O pH tende a aumentar se a concentração a [A– ] for maior que [HA]
III. O pH tende a diminuir se a concentração a [A– ] for maior que [HA]
IV.O pH tende a aumentar se a concentração a [A– ] for menor que [HA]
V. O pH tende a diminuir se a concentração a [A– ] for menor que [HA]
Assinale a alternativa correta:
Os indicadores são substâncias naturais ou sintéticas que apresentam cores bem distintas em ácido e básico. Para uma série de indicadores, as seguintes cores e faixa de pH sobre a qual a mudança de cor ocorre são apresentadas na tabela abaixo:

Assinale a alternativa que apresenta a afirmação
CORRETA:
O pH é uma medida da intensidade do caráter ácido ou básico de uma solução e é dado pela atividade do íon hidrogênio (H+). A medida do pH de uma solução pode ser realizada por diferentes métodos como o uso de indicadores ácido-base, indicadores universais e eletrométrico. O método eletrométrico utiliza um aparelho chamado pHmetro (peagâmetro ou medidor de pH) constituído basicamente de um potenciômetro e um eletrodo de hidrogênio. Assim, analise as afirmativas abaixo sobre pH e o uso e funcionamento do pHmetro.
I) A medição do pH pelo uso do pHmetro consiste na medição da diferença de potencial resultante da diferença de concentração de íons H+ entre a solução interna do eletrodo e a amostra, sendo convertido para a escala de pH.
II) O pH é uma propriedade expressa em mol/L. A escala de pH, compreendida entre 0 e 14, indica se o meio é ácido, básico ou neutro.
III) O eletrodo combinado de pH consiste de duas partes confeccionadas de vidro: um eletrodo de pH, que corresponde a parte interna, e outro eletrodo de referência, que corresponde a parte externa.
IV) Após o uso do pHmetro, o eletrodo de pH deverá ser guardado com a capa protetora do bulbo contendo água deionizada.
O íon potássio em 250,0 mL de uma amostra de água mineral foi precipitado com tetrafenilborato de sódio:
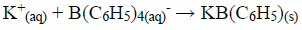
O precipitado foi filtrado, lavado e redissolvido em um solvente orgânico. Um excesso de quelato EDTA/mercúrio(II) foi adicionado:
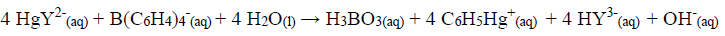
O EDTA liberado foi titulado com 30,00 mL de Mg2+ 0,0550 mol L-1.
(Dado: K = 39 g mol-1, Mg = 24 g mol-1)
Após a análise, a concentração aproximada do íon potássio em partes por milhão será:
Um copo, com capacidade de 250 mL, contém 100 mL de uma solução aquosa 0,10 mol L-1 de ácido acético na temperatura de 25°C. Após a adição de mais 100 mL de água pura a essa solução, com a temperatura permanecendo constante, as consequências sobre a concentração de íons acetato (mol L-1) e quantidade de íons acetato (mol), respectivamente são:
Dados: Ka = 1,8.10-5, √1,8x10-6 = 0,0013 e √9x10-7
= 0,0095.
A constante de equilíbrio KC para a seguinte reação é 0,80 a uma dada temperatura. Um recipiente de 5,00L contém 0,4 mol de FeBr3, 0,5 mol de FeBr2 e 0,4 mol de Br2 nessa temperatura.
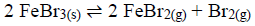
Com base no exposto, assinale a alternativa CORRETA.