Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.163 questões
No processo de tingimento de fibras de nylon, o efluente não tratado do banho de corante na fibra foi preparado com solução
tampão de ácido acético e acetato de sódio, em uma concentração de 0,60 g .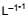 e 1,64 g . L−1, respectivamente.
e 1,64 g . L−1, respectivamente.
Dados:
log1 = 0; log0,5 = −0,3 log2 = 0,3
pKa do ácido acético = 4,74
massas molares (g.mol−1): ácido acético = 60; acetato de sódio = 82
O pH estimado do efluente será
Atenção: Para responder à questão, considere as informações abaixo.
A produção de metano no biogás através de biodigestores pode ser realizada através de digestão anaeróbia por duas classes de bactérias metanogênicas, as hidrogenotróficas e as acetoclásticas. As produções de metano por estas bactérias estão representadas pelas equações (1) e (2), respectivamente. O processo representado pela equação 2 é responsável pela produção de 70% do metano.
Dados:
R = 0,082 atm.L. K−1
4 H2(g) + CO2(g)  CH4(g) + 2H2O (l) (1)
CH4(g) + 2H2O (l) (1)
CH3COOH(l)  CH4(g) + CO2 (g) (2)
CH4(g) + CO2 (g) (2)
(Extraído e adaptado de: http://www.tcc.sc.usp.br/tce/disponiveis/18/180500/tce.../Oliveira_Rafael_Deleo_e.pdf)
Ao término de uma aula experimental, foi gerada uma solução aquosa com concentração de íons OH− igual a 1,0x10−2 mol.L −1. O técnico de laboratório providenciou a neutralização dessa solução e realizou o descarte adequado.
Com base nessa situação hipotética, assinale a alternativa que apresenta o pH dessa solução antes de ocorrer a neutralização.
Com relação a esse caso hipotético, é correto afirmar que o(a)
(Disponível em <http://www.epa.gov/lead/learn-about-lead> Acesso em:26 fev. 2016.)
Assinale a equação iônica simplificada que representa CORRETAMENTE a reação que ocorre quando as soluções de Pb(ClO3)2 e Na2SO4 são misturadas:
SO2(g) + ½O2(g) ⇋ SO3(g)
A expressão da constante de equilíbrio KC, com base na lei de ação das massas, para esta reação é
A tabela a seguir fornece os valores de pH ou pOH de soluções.

Arespeito da concentração molar de íons hidrogênio [H+] presente nas soluções, é CORRETO afirmar:
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
A reação 2HI(g) 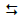 H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
CaCO3(s)
 CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
O deslocamento do equilíbrio no sentido dos produtos é mais favorecido com
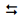 H2
(g) + I2
(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
H2
(g) + I2
(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc. 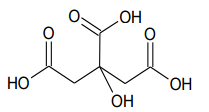
Assinale a opção que expressa a acidez da amostra. Dados. Massa molar. Ácido Cítrico: 192 g.mol –1 .
