Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.173 questões
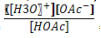 = 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )
= 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )A indicação da presença de mercúrio em solução pode ser obtida pela observação da formação de precipitado por meio da utilização de soluções de:
I. cromato de potássio
II. ácido clorídrico
III. hidróxido de sódio
IV. nitrato de sódio
Assinale:
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
Uma amostra de uma substância desconhecida A reagiu com uma solução de ácido clorídrico concentrado. Durante a reação foi observada a evolução de um gás que, ao borbulhar em uma solução de cloreto de bário forneceu um precipitado B. A solução resultante da reação A + HCl, ao ser gotejada sobre uma solução de sulfato de sódio, forneceu, por sua vez, um precipitado C.
O ensaio indica que os compostos A, B e C podem ser, respectivamente:
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
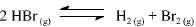
Com base nessas informações, julgue o item que se segue.
Se 0 HBr(g) for colocado em um recipiente fechado, sob
pressão inicial de 0,10 bar, e a temperatura do sistema for
elevada a 500 °C, a pressão parcial de H2(g), quando atingido o
equilíbrio, deve ser maior que 1,0 x 10-7 bar.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
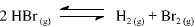
Com base nessas informações, julgue o item que se segue.
A 500 K, a constante de equilíbrio para a reação 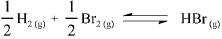 é maior que 1,0 x 104
é maior que 1,0 x 104
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
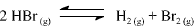
Com base nessas informações, julgue o item que se segue.
Um aumento de temperatura provoca um aumento da
velocidade da reação apresentada.
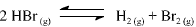
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
Ao final, ele obteve um suco com concentração hidrogeniônica de
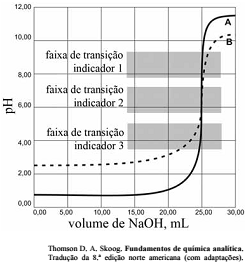
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A titulação representada pela curva A mostra uma solução mais ácida do que a mostrada pela curva B.
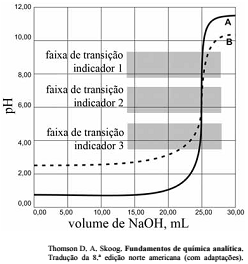
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A figura mostra a titulação de um ácido fraco com uma base forte.
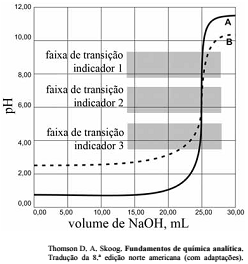
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Qualquer um dos três indicadores ácido base mostrados na
figura podem ser usados para titulação de soluções mais
diluídas.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
A constante de equilíbrio da reação apresentada pode ser corretamente expressa como
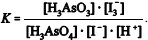
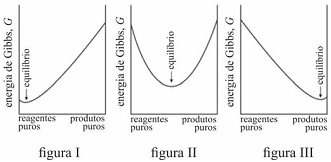
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
A reação representada no gráfico da figura II não se encontra em equilíbrio.
2KNO3(s) + S(s) + 3C(s) → K2S(s) + N2(g) + 3CO2(g)
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O → NO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativos à análise gravimétrica e aos fatores que a influenciam.
A técnica gravimétrica de precipitação em solução homogênea
consiste na precipitação do analito por um agente precipitante
que é gerado por uma reação química lenta na própria solução.