Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.163 questões
Supondo que essa contaminação da água seja por um monoácido, a concentração desse monoácido, em mol/L, encontrada na água dessa caixa é igual a
Ao se preparar uma solução tampão, a substância mais indicada para ser adicionada a essa solução de ácido é
A concentração dos íons acetato e o pH da solução ácida serão, respectivamente,
Assinale a alternativa CORRETA.
Se um precipitado de cromato de prata está em equilíbrio com sua solução saturada, pode-se afirmar que há um equilíbrio heterogêneo
PORQUE
o Ag2CrO4 está na fase sólida, enquanto íons Ag⁺ e CrO42⁻ estão na fase dissolvida, sendo a expressão do produto de solubilidade igual à soma das concentrações molares dos íons. Assinale a alternativa CORRETA.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Um tanque contendo metano, a 20 ºC e a 200 atm, possui maior quantidade do gás do que a quantidade estimada com a equação dos gases ideais.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

A constante de equilíbrio K’ para a reação abaixo, na temperatura T, é igual a (1/K) 2 .
½ CH3OH(g) ⇌ ½ CO(g) + H2(g)
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Para a reação II, o emprego de pressões elevadas favorece a formação dos produtos tanto do ponto de vista do equilíbrio químico, quanto da cinética. Entretanto, o emprego de temperaturas elevadas favorece a formação dos produtos do ponto de vista da cinética, mas desfavorece do ponto de vista do equilíbrio
Com base no texto acima, julgue os itens a seguir.
Em procedimentos que envolvam a calcinação do precipitado após filtração com filtro de papel, a filtração deve ser realizada com papel de filtro quantitativo, o qual produz quantidade mínima ou nenhuma cinza.
Em meio aquoso, ele se ioniza de acordo com a equação simplificada (I) abaixo.
(I) HC2H3O2(aq)
 H+(aq) + C2H3O2−(aq)
H+(aq) + C2H3O2−(aq) Ácido clorídrico é um ácido muito forte e, em meio aquoso, ele se ioniza de acordo com a equação simplificada (II) abaixo.
(II) HCl(aq) → H+(aq) + Cl−(aq)
Na reação da base forte hidróxido de sódio 0,1 mol/L com o ácido etanoico 0,1 mol/L, e com o ácido forte
 0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações:
0,1 mol/L, ambos em meio aquoso, ocorrem as seguintes reações: (III) NaOH(aq) + HC2H3O2(aq) → NaC2H3O2(aq) + H2O(l)
(IV) NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sobre a ionização em (I) e (II) e as reações de neutralização em (III) e (IV), tem-se que:
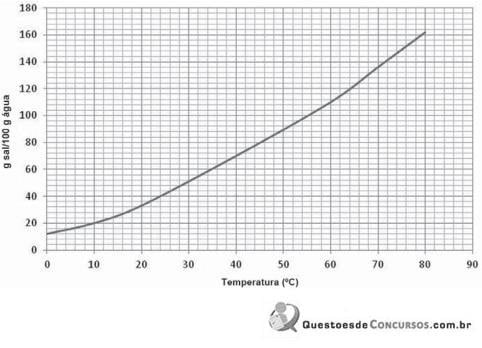
Uma solução saturada desse sal pesando 170 g e na temperatura de 40 °C foi resfriada a 10 °C. A massa do sal, em g, que precipita formando um sólido no fundo do frasco (corpo de fundo) é aproximadamente igual a
Frasco 1: pH = 2
Frasco 2: pH = 12
Frasco 3: pH = 7
Frasco 4: pH = 4
Frasco 5: pH = 10
A partir dos valores de pH obtidos, o técnico deve ter concluído que a substância possivelmente presente no frasco
No entanto, se, em uma certa temperatura constante, esse processo alcança uma situação de equilíbrio, e o valor de constante de equilíbrio, “K”, é igual a 1, a quantidade de reagente no equilíbrio é
CaSO4 (s)
 Ca2+ (aq) + SO42-(aq) ?H > 0
Ca2+ (aq) + SO42-(aq) ?H > 0Sobre esse equilíbrio e o distúrbio causado por mudanças nas condições experimentais, tem-se que a(o)
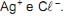 Se, a 25 °C, em 1 L de solução aquosa saturada há 1 x 10-5 mol de AgC l dissolvido, o valor de Kps desse sal, nessa temperatura, é
Se, a 25 °C, em 1 L de solução aquosa saturada há 1 x 10-5 mol de AgC l dissolvido, o valor de Kps desse sal, nessa temperatura, é 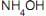 até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de
até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de  , (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.
, (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.A etapa que apresenta sua definição de acordo com os princípios da análise gravimétrica é:
Considerando os limites desse método e os resultados experimentais dessa análise, a concentração em g/L, de NaCl na amostra é
Dado: M(NaCl) = 58.5 g/mol
1 -
2 -
3 -

4 -
5 -
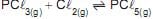
Em relação a esses sistemas, verifica-se que
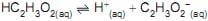
A constante de equilíbrio desse ácido fraco foi determinada experimentalmente medindo-se o pH de uma solução aquosa de ácido acético 0,1 mol/L.
O pH medido foi igual a 3; logo, a constante de equilíbrio,
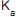 é, em módulo, aproximadamente igual a
é, em módulo, aproximadamente igual a