Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
I. As titulações são baseadas em uma reação entre o analito e um reagente padrão.
II. A titulação volumétrica envolve a medida de volume de uma solução de concentração conhecida necessária para reagir completamente com o analito.
III. Na titulação coulométrica, o “reagente” é uma corrente elétrica direta constante de grandeza conhecida que consome o analito.
IV. Em qualquer titulação o ponto de equivalência química, experimentalmente chamado de ponto final, é assinalado pela variação da cor de um indicador ou da resposta de um instrumento.
Estão corretas as afirmativas:
NH4 + (aq) + H2O(l) NH 3 (aq) + H3O+ (aq) Ka = 5,70 x 10-10
NH 3 (aq) + H2O(l) NH4+ (aq) + OH- (aq) Kb = 1,75 x 10-5
Sabe-se que
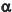 0 e
0 e 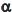 1 são as frações da concentração total da espécie não dissociada e CT (concentração total) é a soma das concentrações analítica das espécies e sua espécie conjugada.
1 são as frações da concentração total da espécie não dissociada e CT (concentração total) é a soma das concentrações analítica das espécies e sua espécie conjugada.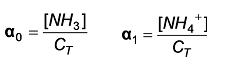
Indique a alternativa correta para quando este sistema possuir os valores de
 0 e
0 e  1 iguais.
1 iguais.

Marque a alternativa que apresenta o correto procedimento para dificultar este processo de corrosão:
Quantos gramas de Ca3(P04)2 são formados?
assertivas.

II. Não haverá o desprendimento de Cl2(g) ou O2(g).
III. A mistura das soluções será apenas um fenômeno físico.
IV. Haverá a formação de um precipitado.
V. Não ocorrerá reação, pois não será possível a formação de um precipitado.
É correto o que se afirma em :
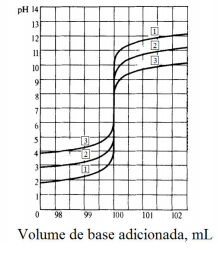
clássico, amplamente empregado para a determinação da
acidez ou da alcalinidade. A figura abaixo mostra as
curvas de titulação de um ácido forte, com três
concentrações diferentes, e uma base forte.
Indicador Intervalo de pH de viragem Mudança de cor
Vermelho de metila 4,4 a 6,2 Vermelho para amarelo
Alaranjado de metila 3,0 a 4,5 Vermelho para amarelo
A 25 ºC, esses dois indicadores devem apresentar-se com a cor amarela em presença de
Para ser comercializado, o biodiesel deve obedecer a uma série de especificações, como, por exemplo, o índice de acidez. Esse índice é determinado dissolvendo-se uma massa conhecida do biodiesel em álcool etílico a 95% e, em seguida, titulando-se a mistura com uma solução aquosa de KOH. Como indicador, utiliza-se a fenolftaleína, que atinge coloração rosa, após adição de base acima de determinado pH, e cujas as formas, protonada e não protonada, são apresentadas nas figuras abaixo.
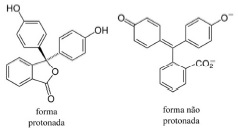
O índice de acidez é considerado como a quantidade, em miligramas, de KOH necessária para neutralizar 1,0 g da amostra, sendo que o valor máximo estabelecido pela norma ASTM D6751 é de 0,5 mg de KOH/g de amostra. Considerando as informações acima e a massa molar do KOH, com valor igual a 56,1 g/mol, julgue os itens subsequentes.
Considerando-se a constante de dissociação ácida do ácido acético igual a 1,75 × 10–5 , na titulação de 50 mL de ácido acético 0,2 mol/L–1 com NaOH 0,05 mol/L–1 , após a adição de 10 mL de NaOH, será observado um valor de pH entre 3 e 4.
O pH do solo influencia também na coloração das flores de algumas espécies de plantas, a exemplo das hortênsias, que, em solos ácidos, produzem flores azuis e, em solos alcalinos, flores cor de rosa.
Considerando-se as informações do texto e a relação entre o valor de pH é a concentração de íons H3O+ e OH− , em soluções aquosas, é correto concluir:

