Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
A constante de equilíbrio da reação entre o nitrato de prata e o cloreto de sódio, referida no texto, é menor que 1.
A eventual dissolução de nitrato de amônio em água causaria a diminuição do pH da água.
Em um mundo cada vez mais propenso à ecologia e sustentabilidade, os tecidos não tecidos (TNT) biodegradáveis aparecem com mais evidência. Descartáveis higiênicos de polipropileno e fraldas podem ser substituídos por poliésteres alifáticos biodegradáveis. Nesse contexto, julgue os itens subsequentes.
O ácido PLA é degradado pela natureza, com a ação de enzimas, por hidrólise.
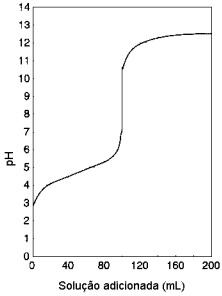
Considerando as soluções 0,1 mol/L de ácido acético, de ácido clorídrico, de hidróxido de sódio e de amônia, pode-se afirmar que a curva refere-se à adição da solução de
sistema A: Cr2O7 2- (aq) + H2O (l) ⇄2 CrO42-(aq) + 2 H+ (aq)
sistema B: 2 NO2 (g) ⇄ N2O4 (g) ΔHo = -58 kJ
Cada sistema em equilíbrio foi submetido, separadamente, a duas perturbações, descritas a seguir:
I – Foram adicionadas gotas de solução de NaOH no sistema A.
II – Foram adicionadas gotas de solução de HCl no sistema A.
III – Foi aumentada a pressão do sistema B por meio de redução de volume.
IV – O sistema B foi aquecido.
Pode-se afirmar que as cores predominantes dos sistemas A e B após as perturbações I, II, III e V, foram, respectivamente,
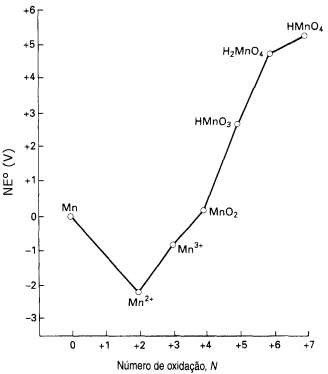
Fonte: SHRIVER, D. F.; ATKINS, P.W, C.H. Química Inorgânica, 3ª edição, Porto Alegre:
A partir da análise do diagrama, pode-se afirmar que a espécie de manganês que se apresenta com o estado de oxidação mais estável em meio ácido, e uma das espécies de manganês que sofre desproporcionamento espontaneamente são, respectivamente,
Dados: Mg = 24,3 g mol -1 ; H = 1,0 g mol -1 ;Cl = 35,5 g mol -1 ; log 2=0,30.
PCl5(g) ⇌ PCl 3(g)+ Cl 2(g)
A 250oC a referida reação apresenta Kρ = 1,8. Para que a reação apresente um fator de conversão em PCl3 e Cl2 de 30%, qual a pressão aproximada que deve ser aplicada ao sistema?
A concentração de Al3+,em mol/L, na solução, é igual a
A 25,00 mL dessa solução adicionou-se, lentamente e com agitação constante, uma solução aquosa de hidróxido de amônio até a precipitação completa de hidróxido de Fe III (Reação I).
Fe3+ (aq)+ 3 OH - (aq) → Fe(OH) 3(s) Reação I
Após envelhecimento do precipitado em sua água-mãe, procedeu-se à filtração e à lavagem do precipitado. O precipitado foi transferido para um cadinho previamente tarado, onde foi feita a sua calcinação (Reação II).
2Fe(OH) 3(s) → Fe2 O 3(s) + 3H2 O(g) Reação II
Sendo a massa de Fe2 O3(s)obtida após a calcinação, igual a 0,40 g, qual a concentração de Fe 3+ na solução original, em g/L?
Dados:
massa molar do Fe = 56 g/mol
massa molar do Fe2 O3 = 160 g/mol
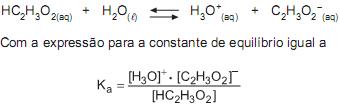
Princípio de Le Chatelier: “Se um sistema em equilíbrio é submetido a uma perturbação, o sistema se ajusta de modo a contrapor os efeitos da perturbação e alcançar uma nova situação de equilíbrio”.
Com base nesse princípio, na expressão da constante Ka, e considerando temperatura e força iônica constantes, após a adição de 1 mL de solução aquosa de NaOH 1 mol/L à solução contendo acetato de sódio e ácido acético, uma nova situação de equilíbrio seria alcançada após o(a)

