Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
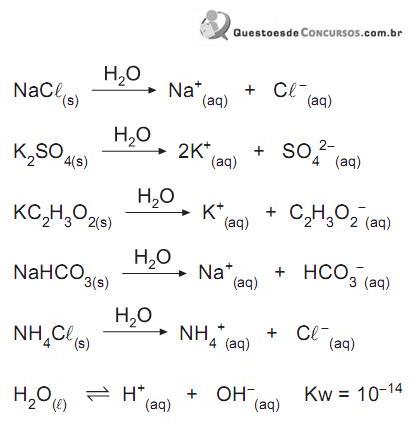
Considerando os íons dos sais que reagem com a água (hidrólise) e os que não reagem, afirma-se que a solução aquosa de
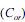 e na fase aquosa
e na fase aquosa 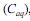 , quando atingido o
, quando atingido o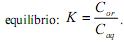
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
A fração do composto extraída pelo estudante B será maior que a extraída pelo estudante A.
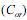 e na fase aquosa
e na fase aquosa 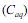 , quando atingido o
, quando atingido o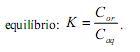
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
Caso o composto seja um ácido que sofra ionização em água, então, a fração extraída será tanto maior quanto mais elevado for o pH da fase aquosa.
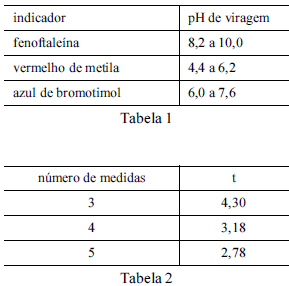
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes
Entre os indicadores apresentados na tabela 1, o mais
adequado à titulação em questão é o vermelho de metila.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam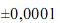 g, para uma simples leitura na balança utilizada, e
g, para uma simples leitura na balança utilizada, e 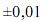 mL, para uma leitura de menisco no balão, julgue o próximo item.
mL, para uma leitura de menisco no balão, julgue o próximo item.
O desvio padrão relativo para a concentração da solução de biftalato de potássio preparada é maior que 1,0×10-4 .

Com base nessas informações, julgue os itens que se seguem.
Considerando-se que, a uma dada temperatura T, o sistema acima descrito, no equilíbrio, apresente uma quantidade de íons
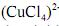 igual à quantidade de íons
igual à quantidade de íons 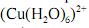 e o coeficiente de atividade de todas as espécies iguais a 1, é correto concluir que a concentração de íons
e o coeficiente de atividade de todas as espécies iguais a 1, é correto concluir que a concentração de íons 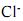 será superior a 0,50.
será superior a 0,50. 
Com base nessas informações, julgue os itens que se seguem.
Caso, na reação acima, a coloração amarela torne-se mais intensa ao se aumentar a temperatura do sistema, é correto concluir que a reação será endotérmica no sentido da formação de
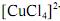 .
. 
Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
De acordo com a nomenclatura sistemática, o composto
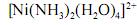 denomina-se diamintetraaquoniquelato.
denomina-se diamintetraaquoniquelato. 
Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
A constante de equilíbrio K pode ser calculada por meio da expressão K =
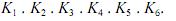

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Nos complexos de coordenação, os ligantes atuam como ácidos de Lewis.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Considerando-se que o complexo
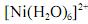 possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller.
possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller. água. Essa substância é também a mais abundante no organismo
humano. Sendo a água tão comum, tem-se a tendência de considerar
triviais suas propriedades químicas e físicas. Entretanto, ela possui
muitas propriedades não usuais e essenciais à vida na Terra. Uma
das propriedades mais importantes da água é a sua capacidade de
dissolver uma grande variedade de substâncias. Por essa razão, a
água é encontrada na natureza com um vasto número de substâncias
nela dissolvidas. Como exemplo dessas substâncias, podem-se citar
materiais radioativos, matérias orgânicas, coloides e metais
pesados, entre outros.
Tendo o texto acima como referência inicial, julgue os itens a
seguir, a respeito de aspectos diversos de química.
O equilíbrio químico é o estudo das reações químicas em que não existe mais tendência a mudar a composição da mistura de reação. O estado de equilíbrio representa uma conciliação entre duas tendências opostas: entalpia versus entropia. Assinale a alternativa correta acerca desse assunto.
Detergentes vendidos comercialmente (sólidos ou líquidos) são misturas complexas formadas por um grande número de compostos químicos. Qualquer discussão acerca dos efeitos poluentes ou ecológicos dos detergentes, inevitavelmente, diz respeito a um ou mais dos seus componentes e dos seus comportamentos químicos em meio aquoso.
F.R. Benn e C.A. Mc Auliffe. Química e poluição. São Paulo: Ed. da USP, 1981, p.113 (com adaptações).
Considerando essas informações, assinale a alternativa correta.
Muitos aquíferos apresentam capacidade tamponante. Em alguns deles, essa característica se deve ao equilíbrio do HCO3- e do CO3- . Caso esse equilíbrio esteja presente, em uma situação tal que [CO3- ]=0,048 mol/L e [HCO3- ]=0,80 mol/L, e sabendo que pKa2 do H2CO3 é igual a 10,25, assinale a opção que apresenta a faixa de valores em que se encontra o pH dessa solução-tampão, sabendo que log0,06 = -1,25.
É bastante comum as águas naturais serem soluções mistas, muitas vezes com capacidades tamponantes. Com relação a soluções mistas e tampões, julgue os itens abaixo como Verdadeiros (V) ou Falsos (F) e, em seguida, assinale a opção correta.
I – A adição de íons acetato em uma solução de ácido acético provocará um aumento do pH da solução.
II – A capacidade tamponante diz respeito aos diversos valores de pH a que um tampão pode ser ajustado.
III – Se o pKa de uma reação de equilíbrio entre um ácido e sua base conjugada é igual a 4,8, então um tampão formado pelo equilíbrio desse ácido com sua base conjugada poderá ser ajustado somente para valores de pH maiores que 4,8.
A sequência correta é:
As águas de rios e lagos contêm quantidades significativas de dióxido de carbono. Nessa situação, o seguinte equilíbrio se estabelece: CO2(g) + H2O(l) ⇌ H2CO3(aq). Considerando esse equilíbrio, julgue os itens abaixo como Verdadeiros (V) ou Falsos (F) e, em seguida, assinale a opção correta.
I – A dissolução do CO2 na água diminui o pH da água.
II – O H2CO3 é um ácido fraco, pois na primeira dissociação libera H+, por meio da reação: H2CO3 ⇀ H+ + HCO3- , mas na segunda dissociação, que não é completa, libera OH- , conforme a reação: HCO3- ⇀ CO2 + OH- , o que reduz a quantidade de H+ disponível na solução.
III – O HCO3- é a base conjugada do H2CO3 e é considerada uma base forte.
IV – A dissolução de um ácido na água aumenta a condutividade da água.
A sequência correta é:
A química de águas calcárias é predominantemente dominada pelo equilíbrio:
CaCO3(s) + H2O(l) ⇌ Ca+2 + HCO3- + OH- ------K
Esse equilíbrio é resultante da ocorrência de dois outros equilíbrios:
CaCO3(s) ⇌ Ca+2 + CO32- --------- KPS=4,6 × 10-9
CO32- + H2O ⇌ HCO3- + OH- -------- Kb
Considerando que a constante ácida (Ka) do HCO3- é igual a 4,7 × 10-11 e Kw é igual a 1,0 × 10-14, assinale a opção que apresenta o valor da constante de equilíbrio K.