Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
De acordo com o procedimento adotado na situação hipotética descrita, julgue os itens que se seguem.
Caso o emprego de ácido clorídrico diluído resulte na formação de um precipitado, então a amostra pode ser constituída de metais do grupo I. Nesse caso, o precipitado deve ser separado por filtração e examinado com relação a esse grupo. Alternativamente, a amostra original pode ser diretamente dissolvida em ácido nítrico concentrado.
Os diversos componentes presentes na água, que alteram seu grau de pureza, podem ser retratados em termos de suas características físicas, químicas e biológicas. Essas características podem ser traduzidas na forma de parâmetros de qualidade da água. Acerca desse assunto, julgue o item seguinte.
O pH das águas naturais depende da presença de substâncias
dissolvidas que possuam propriedades ácido-básicas, e o seu
valor sofre influência da dissolução de rochas, da absorção de
gases da atmosfera, da oxidação da matéria orgânica e da
fotossíntese.
Durante uma aula de experimentação no laboratório da escola, um professor solicitou aos alunos que preparassem soluções utilizando um alvejante comercial e vinagre. De cada solução preparada, foram separadas duas amostras em diferentes tubos de ensaio e adicionadas gotas de indicadores, conforme a tabela a seguir.
Tubo de Ensaio
I - Alvejante
II - Vinagre
III - Alvejante
IV - Vinagre
Indicador adicionado
Extrato de repolho roxo
Extrato de repolho roxo
Verde de bromocresol
Verde de bromocresol
As cores observadas após a adição dos indicadores no tubos
de ensaio I, II, III e IV são, respectivamente,
A indicação da presença de mercúrio em solução pode ser obtida pela observação da formação de precipitado por meio da utilização de soluções de:
I. cromato de potássio
II. ácido clorídrico
III. hidróxido de sódio
IV. nitrato de sódio
Assinale:
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
Uma amostra de uma substância desconhecida A reagiu com uma solução de ácido clorídrico concentrado. Durante a reação foi observada a evolução de um gás que, ao borbulhar em uma solução de cloreto de bário forneceu um precipitado B. A solução resultante da reação A + HCl, ao ser gotejada sobre uma solução de sulfato de sódio, forneceu, por sua vez, um precipitado C.
O ensaio indica que os compostos A, B e C podem ser, respectivamente:
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
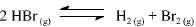
Com base nessas informações, julgue o item que se segue.
Se 0 HBr(g) for colocado em um recipiente fechado, sob
pressão inicial de 0,10 bar, e a temperatura do sistema for
elevada a 500 °C, a pressão parcial de H2(g), quando atingido o
equilíbrio, deve ser maior que 1,0 x 10-7 bar.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
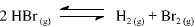
Com base nessas informações, julgue o item que se segue.
A 500 K, a constante de equilíbrio para a reação 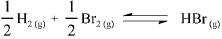 é maior que 1,0 x 104
é maior que 1,0 x 104
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
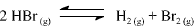
Com base nessas informações, julgue o item que se segue.
Um aumento de temperatura provoca um aumento da
velocidade da reação apresentada.
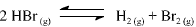
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
 3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a
3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a