Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.201 questões
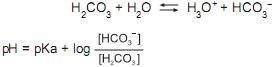
Sobre o equilíbrio de um sistema contendo 100 mL de solução 0,1 mol/L de H 2CO3 e 0,1 mol/L de HCO3– , quando se adiciona(m)
No meio aquoso, esses dois sais reagem instantaneamente, de acordo com a equação balanceada abaixo, e nela se forma um sal muito pouco solúvel.

A quantidade máxima, em gramas, de AgCL sólido (massa molar = 143,5 g/mol e Kps = 10-10 ) que se forma é de, aproximadamente,
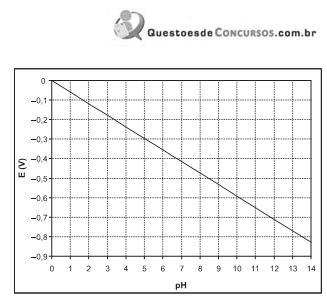
Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas
Dado: pF = -log [F- ]
Sobre essa análise potenciométrica, afirma-se que o(a)
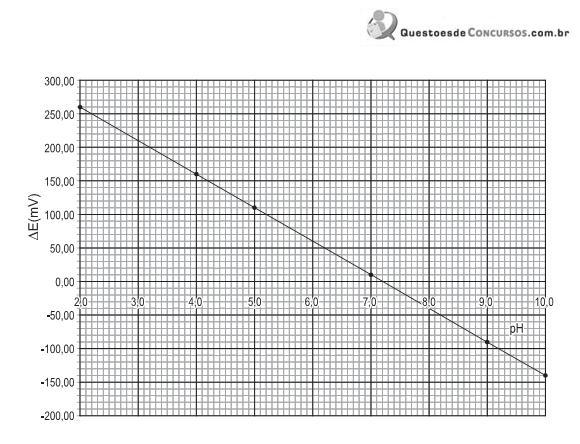
A partir da análise do gráfico, o módulo do fator de resposta, em mV/pH, é
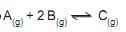 foi determinada em diferentes temperaturas, como mostra a tabela abaixo.
foi determinada em diferentes temperaturas, como mostra a tabela abaixo.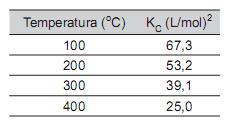
A esse respeito, considere as afirmativas a seguir
I - O aumento da temperatura aumenta a quantidade de produto formada.
II - Trata-se de uma reação com ΔH menor que zero.
III - O aumento da pressão aumenta a quantidade de produto formada.
IV - Na temperatura de 100 °C, o equilíbrio foi alcançado mais rapidamente que a 400 °C.
Estão corretas APENAS as afirmativas
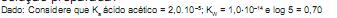

Qual o valor da constante de equilíbrio, em (mol/L) -2 , para esse sistema?
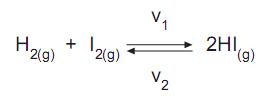
A reação química entre o iodo e o hidrogênio é uma reação reversível, que produz iodeto de hidrogênio. A velocidade de reação direta é
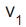 e a velocidade de reação inversa é
e a velocidade de reação inversa é 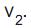 Qual a característica que se estabelece ao atingir o equilíbrio químico no sistema acima?
Qual a característica que se estabelece ao atingir o equilíbrio químico no sistema acima?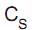 = 180 g/100 g
= 180 g/100 g 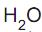 . Qual a massa de água, em gramas, presente numa solução saturada que contenha 36 g desse sal na mesma temperatura?
. Qual a massa de água, em gramas, presente numa solução saturada que contenha 36 g desse sal na mesma temperatura?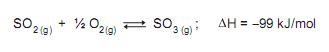
Com relação a essa reação no equilíbrio, afirma-se que o(a)
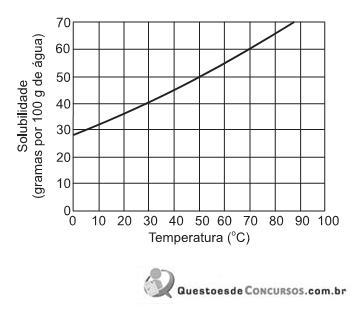
A massa de cloreto de amônio presente em 250 g de uma solução saturada a 50 °C é, em gramas, aproximadamente,
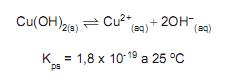
Sendo o valor do pH ideal da água da piscina igual a 6, a quantidade máxima de CuSO4 . 5H2 O em massa, que deve ser adicionada a uma piscina de volume igual a 10.000 L, com água no pH ideal, em kg, é
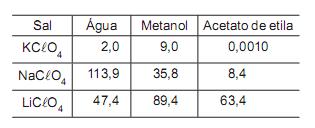
O sal diet é uma mistura de cloreto de potássio e cloreto de sódio, contendo quantidade traço de cloreto de lítio. Uma amostra de 4,5 g seca de sal diet foi pesada e analisada para determinar-se a percentagem em massa de cloreto de potássio. Para tal, a mistura de cloretos alcalinos foi tratada com ácido perclórico de modo a converter os sais cloretos em sais percloratos. A amostra foi seca e, em seguida, foi adicionada em 100 mL de acetato de etila, nos quais o potássio se precipitou na forma de KClO4 (ver dados de solubilidade na tabela acima). O sobrenadante foi separado, e o precipitado lavado com acetato de etila, antes de ser seco e pesado na balança analítica. Qual a percentagem, em massa, de KCl na amostra se a massa de KClO4 obtida foi igual a 2,77 g?
Adicionando-se cloreto de sódio na proporção de 2 mol/L de solução, qual o teor residual de prata, em mol/L, que permanecerá solúvel?
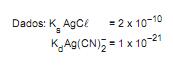
- o produto precipitado deve ser suficientemente insolúvel para que não ocorram perdas na filtração e lavagem;
- a natureza física do precipitado deve ser tal que permita ser separado da solução por filtração e possa ser lavado até ficar livre de impurezas solúveis;
- o produto precipitado deve ser conversível em uma substância pura de composição química;
- o agente precipitante não deve ser reativo com os constituintes da atmosfera.
Considerando que o produto de solubilidade do AgCl, em água pura, seja 1,6 x 10-10 (Kps a 25 °C) e que a solubilidade do AgCl seja 1,3 x 10-5 mol/L, qual seria a solubilidade de Ag+ em uma solução de NaCl 0,10 M?

