Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
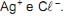 Se, a 25 °C, em 1 L de solução aquosa saturada há 1 x 10-5 mol de AgC l dissolvido, o valor de Kps desse sal, nessa temperatura, é
Se, a 25 °C, em 1 L de solução aquosa saturada há 1 x 10-5 mol de AgC l dissolvido, o valor de Kps desse sal, nessa temperatura, é 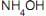 até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de
até precipitação completa do íon Fe3+ , (v) o envelhecimento do precipitado, (vi) a lavagem do precipitado com solução aquosa de 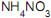 , (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.
, (vii), a filtração em papel de filtro quantitativo, (viii) a calcinação do precipitado filtrado, (ix) o resfriamento do precipitado calcinado e (x) a pesagem.A etapa que apresenta sua definição de acordo com os princípios da análise gravimétrica é:
Considerando os limites desse método e os resultados experimentais dessa análise, a concentração em g/L, de NaCl na amostra é
Dado: M(NaCl) = 58.5 g/mol
1 -
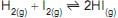
2 -
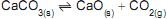
3 -

4 -
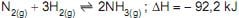
5 -
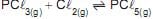
Em relação a esses sistemas, verifica-se que
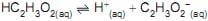
A constante de equilíbrio desse ácido fraco foi determinada experimentalmente medindo-se o pH de uma solução aquosa de ácido acético 0,1 mol/L.
O pH medido foi igual a 3; logo, a constante de equilíbrio,
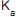 é, em módulo, aproximadamente igual a
é, em módulo, aproximadamente igual a I. Quanto maior a constante de ionização de um ácido, mais forte será esse ácido.
II. Em um ácido poliprótico, a remoção do 2º hidrogênio é bem mais fácil que o 1º hidrogênio.
III. Quanto menor o valor da constante de ionização maior a tendência de liberar H+ .
IV. Para poliácidos o valor da primeira constante de ionização é maior que o da segunda constante.
verifica-se que estão corretas
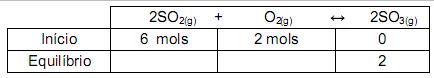
após determinação das lacunas em branco na tabela, o valor da constante de equilíbrio é
Fe3O4(s)+ 4 H2(g)↔ 3 Fe(s)+ 4 H2(g) ΔH = -209,5 kcal.mol -1
e considerando as afirmações seguintes,
I. A adição de um catalisador desloca o equilíbrio para direita.
II. O aumento da pressão desloca o equilíbrio para a esquerda.
III. A diminuição da temperatura desloca o equilíbrio para a direita.
IV. A diminuição da pressão desloca o equilíbrio para a direita.
V. O aumento da temperatura desloca o equilíbrio para a esquerda.
verifica-se que está(ão) correta(s)
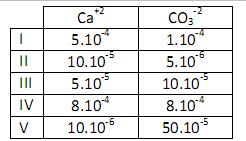
Dessa forma, podemos afirmar que
I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?
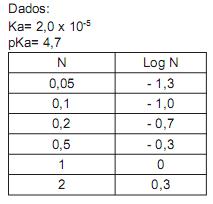
Dado: Kps (CaF2 ) = 3,9 x 10-11

É(São) correta(s) apenas a(s) assertativa(s)
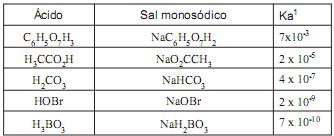
Com base nos valores da constante de equilíbrio da primeira dissociação ácida em meio aquoso (Ka1 ) dos ácidos listados, um dos pares ácido/ sal monosódico foi escolhido para a preparação da solução tampão. Desta forma, massa correspondente a 0,16 mol do sal monosódico foi pesada e transferida quantitativamente para um balão volumétrico de 1 litro. Para se obter 1 litro da solução tampão desejada, a massa do ácido pesada e transferida quantitativamente para o balão volumétrico contendo o sal monosódico deve ser
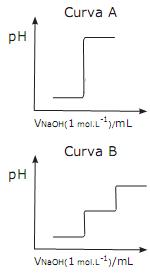
Curva A e Curva B correspondem respectivamente à titulação ácido/base de soluções dos ácidos
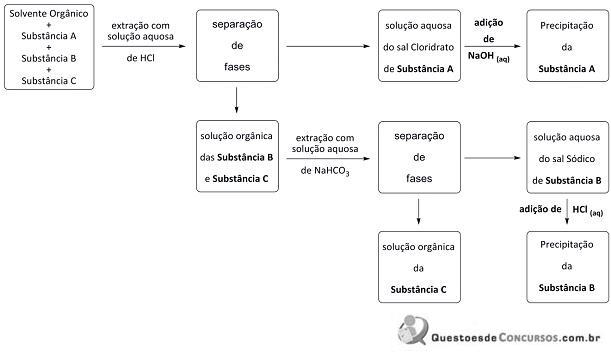
Sabendo que os valores de Ka do ácido clorídrico (HCl) e Ka do bicarbonato de sódio (NaHCO3 ) medidos em água são respectivamente 1,0 x 107 e 4,7 x 10-11 , podemos afirmar que a ordem crescente de valores de Ka das Substância A, Substância B e Substância C deve ser:
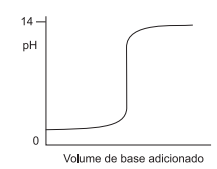
Considere a curva de titulação produzida quando uma base forte é adicionada a um ácido forte.
O pH da solução, quando 50 mL da base forte de concentração de 0,1 mol/L são adicionados a 51 mL do ácido forte de concentração de 0,1 mol/L, é de