Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.196 questões
I. O princípio de Le Châtelier prevê que se um sistema emequilíbrio fica sujeito a uma variação na temperatura,pressão ou concentração de um dos reagentes, o sistemamantém sua posição de equilíbrio de tal forma que o valor daconstante de equilíbrio se mantenha constante. II. A presença de um catalisador no meio reacional aumenta avelocidade na qual o equilíbrio é atingindo, sem alterar acomposição da mistura no equilíbrio. III. As variações nas concentrações ou pressões parciais provocam deslocamentos no equilíbrio sem variação no valor da constante de equilíbrio. Entretanto, o valor daconstante de equilíbrio varia à medida que a temperaturavaria. IV. A uma temperatura constante, a redução do volume de umdos reagentes em uma mistura gasosa em equilíbrio faz queo sistema se desloque no sentido dos reagentes.Quando a concentração de reagentes e produtos em um meio reacional não varia com o passar do tempo, pode-se dizer que a reação chegou a um estado de equilíbrio, em que as reações direta e inversa acontecem com a mesma velocidade. Entretanto, vários fatores podem alterar a posição de equilíbrio de uma reação. Com base nessas informações, julgue os itens a seguir
Estão certos apenas os itens:

Com base nesse processo e nos conceitos de equilíbrio químico, assinale a opção correta.
A respeito da classificação das substâncias e suas características, julgue os itens.
A respeito da classificação das substâncias e suas características, julgue os itens.

Alcoois podem ser formados a partir da reação de hidratação de alcenos catalisada por ácido. Um exemplo é a hidratação do 3,3-dimetil-1-buteno, mostrada acima.
Com relação a essa reação, julgue os itens.
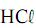 à solução de NaOH, o pH da solução resultante será maior que 12.
à solução de NaOH, o pH da solução resultante será maior que 12.
Com referência à célula galvânica descrita, considerando que as soluções envolvidas apresentam comportamentos ideais e que log 5 = 0,7 e log 2 = 0,3, julgue os itens seguintes.
São situações vantajosas das titulações potenciométricas sobre os métodos clássicos de volumetria, EXCETO:
Considere os seguintes dados referentes a uma reação química:
|
Reagentes |
Produtos |
||
|
[A] |
[B] |
[C] |
[D] |
Estado Inicial |
1 |
2 |
0 |
0 |
Estado de Equilíbrio |
0,5 |
0,5 |
0,5 |
0,5 |
Assinale a alternativa correta:
Assinale qual dessas substâncias que, quando dissolvidas em água, possui um pH básico?
Comparando soluções de mesma concentração das substâncias abaixo, assinale qual possuirá o pH mais ácido:
ma(Pb) = 207u, ma(Cr) = 52u, ma(O) =16u
De acordo com o princípio de Le Chatellier, quando se exerce uma ação sobre determinado sistema em equilíbrio, há maior tendência de reação em um dos sentidos. A decomposição do calcário ocorre de acordo com a representação ao lado:
CaCO3(s) ⇌ CaO(s) + CO2(g)
Sobre o equilíbrio envolvendo essa reação, pode-se afirmar corretamente que:
( ) Baseiam-se em medidas do volume de titulante, estando este volume relacionado à concentração da substância a ser quantificada. ( ) A escolha de um indicador ácido-base na volumetria de neutralização deverá levar em consideração o valor do pH no ponto final da titulação. ( ) Na volumetria de precipitação aplicada à determinação de cloreto, um dos indicadores mais utilizados é o cromato de potássio que forma precipitado amarelo estável com os íons prata do titulante. ( ) Em titulações complexiométricas que utilizam o EDTA como titulante, o pH deverá ser ajustado de acordo com o tipo de analito, possibilitando a formação de complexos estáveis em solução.
A seqüência está correta em:
Considerando-se que Kps CaSO4 = 4,9 x 10 -5 e Kps PbSO4 = 2,5 x 10-8 a 25 oC, as concentrações em mol/L de sulfato, para que ocorra a precipitação do CaSO4 , do PbSO4 e o composto que precipitará primeiro são, respectivamente: