Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.180 questões
PCl5(g) ⇌ PCl 3(g)+ Cl 2(g)
A 250oC a referida reação apresenta Kρ = 1,8. Para que a reação apresente um fator de conversão em PCl3 e Cl2 de 30%, qual a pressão aproximada que deve ser aplicada ao sistema?
Dados de Kps :
BaCO3 = 5,0.10-9 ,
MnCO3 = 5,0.10-10 ,
Ag2 CO3 = 8,1.10-12 ,
ZnCO3 = 1,0.10-11
Dado: pKa do ácido acético = 4,74
equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520°C, é aproximadamente igual a :
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa reação, adiciona-se água e obtém-se uma substância A, que torna vermelho o papel azul de tornassol. Em outro erlenmeyer, faz-se a combustão do magnésio, adiciona-se água e obtém-se uma substância B, que torna azul o papel vermelho de tornassol. Em seguida, promove-se a reação entre A e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
I. O oxigênio pode comportar-se como acelerador do processo eletroquímico de corrosão.
II. A corrosão eletroquímica será tanto mais intensa quanto maior o valor de pH.
III. Na corrosão eletroquímica, o metal se oxida num lugar, o oxidante se reduz em outro e o produto de corrosão se forma em regiões intermediárias, não apresentando características protetoras.
Está(ão) correta(s) a(s) afirmativa(s)
A concentração de cálcio numa solução saturada desse sulfato, em mol L-1 , é
A(g)+2B(g)
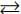 C(g),
C(g),Em relação ao deslocamento do equilíbrio é correto afirmar que:
Os sistemas de refrigeração industrial atualmente utilizados nas indústrias de pescado, laticínios, bebidas, frigoríficos e em
outros setores econômicos baseiam-se na capacidade de algumas substâncias químicas, denominadas agentes refrige-
rantes, absorverem significativa quantidade de calor quando passam do estado líquido para o gasoso.
A amônia é um importante agente refrigerante por apresentar diversas vantagens adicionais, como, por exemplo, a de ser
natural e não agredir a camada de ozônio.
Considere 100 mL de uma solução 0,3 mol.L-1
de amônia que foram diluídos por adição de 50 mL de água destilada. Con-
sidere, também, que a constante de ionização da amônia (Kb) a 25°C é 2 x 10-5.

Os sistemas de refrigeração industrial atualmente utilizados nas indústrias de pescado, laticínios, bebidas, frigoríficos e em
outros setores econômicos baseiam-se na capacidade de algumas substâncias químicas, denominadas agentes refrige-
rantes, absorverem significativa quantidade de calor quando passam do estado líquido para o gasoso.
A amônia é um importante agente refrigerante por apresentar diversas vantagens adicionais, como, por exemplo, a de ser
natural e não agredir a camada de ozônio.
Considere 100 mL de uma solução 0,3 mol.L-1
de amônia que foram diluídos por adição de 50 mL de água destilada. Con-
sidere, também, que a constante de ionização da amônia (Kb) a 25°C é 2 x 10-5.

Indicadores ácido-base Cor e pH
fenolftaleína Incolor em pH ≤ 8,3
Rosa-claro em pH entre 8,3 e 10,0
Vermelho em pH ≥ 10,0
Azul de bromotimol amarelo em pH ≤ 6
azul em pH ≥ 7,6
verde em pH entre 6,0 e 7,6
Alaranjado de metila vermelho em pH ≤ 3,1
alaranjado em pH entre 3,1 e 4,4
amarelo em pH ≥ 4,4
A amostra da água da chuva em contato com a solução de:
Dados que as concentrações iniciais do CH 3 COOH CH3COO– são iguais e valem 0,125 mol/L, o pKa = 4,75, e que log 0,98 = -0,007, pode-se afirmar que:

O pH de uma solução 0,006 mol.L -1 deste ácido, que possui Kaigual a 1,5x10-5 , é, aproximadamente, Dado: log 3 = 0,48