Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.180 questões
Equação 1
2C15H14O3(s) + Na2CO3(aq) ⇔ 2C15H13O3-Na+ (aq) + CO2(aq) + H2O(ℓ)
composto amarelo-claro, insolúvel em água sal de sódio do lapachol, vermelho, solúvel em água
Equação 2
C15H13O3-Na+ (aq) + HCl(aq) ⇔ C15H14O3(S) + NaCl(aq)
Através da análise das equações 1 e 2 acima é INCORRETO afirmar:
Em condições de equilíbrio a uma determinada temperatura, as pressões parciais de CO(g) e CO2(g) são 1,22 atm e 0,780 atm, respectivamente. Podemos afirmar que o valor da constante de equilíbrio para esta reação é
O professor está programando a sua aula de titulação e precisa escolher qual o indicador ácido-base que usará para indicar o final da titulação entre solução aquosa de ácido clorídrico (titulante) e hidróxido de potássio. Dentre as opções que ele dispõe e que estão listadas abaixo, qual a melhor para esta titulação?
Indicador Zona de viragem
Violeta de metila (amarelo) 0,0 – 1,6 (azul-púrpura)
Azul de bromotimol (amarelo) 3,0 – 4,6 (violeta)
Alaranjado de metila (vermelho) 3,4 – 4,4 (amarelo)
Fenolftaleína (incolor) 8,2 – 10,0 (rosa)
Carmin de indigo (azul) 11,4 – 13,0 (amarelo)
Indique, dentre os ácidos listados abaixo, aquele cuja base conjugada será a mais forte:
ácido Ka
Acético 1,75 x 10-5
Bórico 6,4 x 10-10
Benzoico 6,3 x 10-5
Lático 1,4 x 10-4
Oxálico 6,5 x 10-2
A amônia (NH3) é um dos produtos químicos mais importantes para o ser humano, sendo uma das cinco substâncias produzidas em maior quantidade no mundo, sendo utilizada como fertilizantes, produção de plásticos e explosivos. A equação abaixo mostra a reação de obtenção da amônia. Considerando o Princípio de Le Chatelier, identifique uma dascondições necessárias que desfavorece a produção de grandes quantidades de amônia.
N2(g) + 3 H2(g) → 2NH3(g) ∆H= - 92,22 KJ
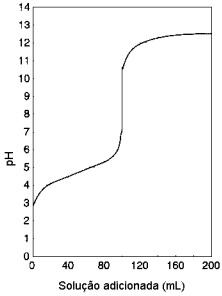
Considerando as soluções 0,1 mol/L de ácido acético, de ácido clorídrico, de hidróxido de sódio e de amônia, pode-se afirmar que a curva refere-se à adição da solução de
sistema A: Cr2O7 2- (aq) + H2O (l) ⇄2 CrO42-(aq) + 2 H+ (aq)
sistema B: 2 NO2 (g) ⇄ N2O4 (g) ΔHo = -58 kJ
Cada sistema em equilíbrio foi submetido, separadamente, a duas perturbações, descritas a seguir:
I – Foram adicionadas gotas de solução de NaOH no sistema A.
II – Foram adicionadas gotas de solução de HCl no sistema A.
III – Foi aumentada a pressão do sistema B por meio de redução de volume.
IV – O sistema B foi aquecido.
Pode-se afirmar que as cores predominantes dos sistemas A e B após as perturbações I, II, III e V, foram, respectivamente,
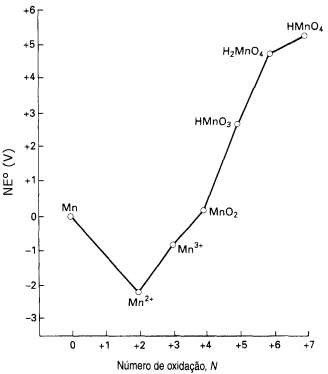
Fonte: SHRIVER, D. F.; ATKINS, P.W, C.H. Química Inorgânica, 3ª edição, Porto Alegre:
A partir da análise do diagrama, pode-se afirmar que a espécie de manganês que se apresenta com o estado de oxidação mais estável em meio ácido, e uma das espécies de manganês que sofre desproporcionamento espontaneamente são, respectivamente,
Dados: Mg = 24,3 g mol -1 ; H = 1,0 g mol -1 ;Cl = 35,5 g mol -1 ; log 2=0,30.