Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520°C, é aproximadamente igual a :
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa reação, adiciona-se água e obtém-se uma substância A, que torna vermelho o papel azul de tornassol. Em outro erlenmeyer, faz-se a combustão do magnésio, adiciona-se água e obtém-se uma substância B, que torna azul o papel vermelho de tornassol. Em seguida, promove-se a reação entre A e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
I. O oxigênio pode comportar-se como acelerador do processo eletroquímico de corrosão.
II. A corrosão eletroquímica será tanto mais intensa quanto maior o valor de pH.
III. Na corrosão eletroquímica, o metal se oxida num lugar, o oxidante se reduz em outro e o produto de corrosão se forma em regiões intermediárias, não apresentando características protetoras.
Está(ão) correta(s) a(s) afirmativa(s)
A concentração de cálcio numa solução saturada desse sulfato, em mol L-1 , é
Os sistemas de refrigeração industrial atualmente utilizados nas indústrias de pescado, laticínios, bebidas, frigoríficos e em
outros setores econômicos baseiam-se na capacidade de algumas substâncias químicas, denominadas agentes refrige-
rantes, absorverem significativa quantidade de calor quando passam do estado líquido para o gasoso.
A amônia é um importante agente refrigerante por apresentar diversas vantagens adicionais, como, por exemplo, a de ser
natural e não agredir a camada de ozônio.
Considere 100 mL de uma solução 0,3 mol.L-1
de amônia que foram diluídos por adição de 50 mL de água destilada. Con-
sidere, também, que a constante de ionização da amônia (Kb) a 25°C é 2 x 10-5.

Os sistemas de refrigeração industrial atualmente utilizados nas indústrias de pescado, laticínios, bebidas, frigoríficos e em
outros setores econômicos baseiam-se na capacidade de algumas substâncias químicas, denominadas agentes refrige-
rantes, absorverem significativa quantidade de calor quando passam do estado líquido para o gasoso.
A amônia é um importante agente refrigerante por apresentar diversas vantagens adicionais, como, por exemplo, a de ser
natural e não agredir a camada de ozônio.
Considere 100 mL de uma solução 0,3 mol.L-1
de amônia que foram diluídos por adição de 50 mL de água destilada. Con-
sidere, também, que a constante de ionização da amônia (Kb) a 25°C é 2 x 10-5.

São dadas as seguintes semi reações:
Considere que a reação da célula é espontânea e que o sistema entra em equilíbrio.
Nessas condições, é CORRETO afirmar que a constante de equilíbrio para a reação da célula é aproximadamente igual a
A análise de uma bebida carbonatada indicou um pH = 4. Qual a concentração, em mol L-1, de íons H+ nesta bebida?
Um erro bastante comum na determinação potenciométrica do pH com eletrodos de vidro é o erro ácido, causado, principalmente, pela saturação da membrana porosa de vidro com íons H+. Esse tipo de erro gera leituras de pH com resultados superiores aos reais.
Ao adicionar cloro gasoso sob pressão numa solução alcalina, o cloro se desproporciona em cloreto e hipoclorito, segundo a reação:

Dados: E0 pH 14 (V): Cl2/Cl- = 1,358; ClO- /Cl2 = 0,421; 2,303.RT/F = 0,059.
A ordem de grandeza da constante de equilíbrio da reação de desproporcionamento é:
Ácido cítrico é um ácido triprótico, cuja primeira constante de acidez é Ka = 7,4 x 10-3 . A uma solução contendo 0,5 mol.L-1 de ácido cítrico, foi adicionado dihidrogenocitrato de sódio, de modo que sua concentração também é de 0,5 mol.L-1 . (Dados: ℓog(7,4) = 0,87.)
O valor de pH da solução final é:
Sais de carbonatos são, na maioria, pouco solúveis. Num experimento, foram adicionadas soluções equimolares de cloretos de bário, cálcio, estrôncio, cádmio e cobalto num meio levemente alcalino.
Dados:
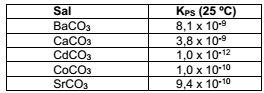
Ao passar do tempo, gás carbônico atmosférico se difunde no meio, causando precipitação de todos os cátions. Após
isso ocorrer, o cátion que estará em maior concentração será o de:
A determinação da concentração de íons cloreto em águas é um importante parâmetro para se medir sua qualidade. Íons cloreto reagem com íons prata, gerando o cloreto de prata insolúvel.
Dados: M (g.mol-1 ): Ag = 108; Cl = 35,5; N = 14; O = 16.
A partir da estequiometria da reação de precipitação do cloreto de prata, a massa de nitrato de prata necessária para reagir com 250 mL de uma amostra contendo 250 mg.L-1 de íons cloreto é:
A água pura a 25°C em equilíbrio com o ar contendo 390 ppm CO2 possui uma concentração de CO2 dissolvido próximo a 1 x 10–5 mol/L, conforme reação a seguir.
CO2 + H2O 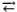 HCO3–
+ H+
HCO3–
+ H+
Considerando que a constante de equilíbrio da reação anterior é igual a 4 x 10–7, qual será o pH da água?