Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.163 questões
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
Em uma titulação de neutralização, caso a adição do indicador gere uma solução de coloração muito escura, aconselha-se adicionar água ao titulado para que a coloração fique mais clara, o que torna mais precisa e exata a detecção do ponto final da titulação.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
Uma maneira de eliminar os erros aleatórios relativos às medidas de volume durante a titulação na situação II é a utilização de uma bureta eletrônica no lugar da vidraria convencional.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2G
foi
reduzido a Cr3+.
Com base nas situações apresentadas acima, julgue o item a seguir, relativos à química analítica clássica.
Diferentemente da volumetria de neutralização, a volumetria
de oxirredução é limitada pela impossibilidade de se utilizar
indicadores que acusem o final da titulação por meio da
mudança de cor do sistema.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
Na situação II, a concentração de Fe2+ na amostra é superior a 0,010 mol/L.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
O ácido titulado na situação I é mais forte que o ácido propiônico, que tem pKa = 4,9.
Considere as situações I e II a seguir. I.
A figura abaixo representa a curva de titulação obtida pela titulação de 50 mL de uma solução de um ácido fraco monoprótico com NaOH 0,1 mol/L, bem como a primeira derivada dessa curva.

II. Na titulação de 20 mL de uma solução de Fe2+, foram
gastos 5 mL de uma solução de dicromato 0,01 mol/L para
que houvesse mudança de cor do indicador. Nesse caso,
o Fe2+ foi completamente oxidado a Fe3+ e o Cr2O7
2- foi
reduzido a Cr3+.
Na situação I, a concentração do ácido titulado é o dobro da concentração da base utilizada nessa titulação.
O pH de uma solução obtida pela mistura de 50 mL de NaOH 0,1 mol/L e 50 mL de HCl 0,25 mol/L é inferior a 2.
Considerando-se que a constante do produto de solubilidade do cloreto de prata em água seja 1,0×10-10 mol/L, em uma solução saturada desse sal a concentração de íons prata será superior a 5,0 mg/L.
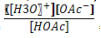 = 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )
= 1,75 x 10-5 e Massa molar de
NaOAc = 82,034 g )A indicação da presença de mercúrio em solução pode ser obtida pela observação da formação de precipitado por meio da utilização de soluções de:
I. cromato de potássio
II. ácido clorídrico
III. hidróxido de sódio
IV. nitrato de sódio
Assinale:
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
Uma amostra de uma substância desconhecida A reagiu com uma solução de ácido clorídrico concentrado. Durante a reação foi observada a evolução de um gás que, ao borbulhar em uma solução de cloreto de bário forneceu um precipitado B. A solução resultante da reação A + HCl, ao ser gotejada sobre uma solução de sulfato de sódio, forneceu, por sua vez, um precipitado C.
O ensaio indica que os compostos A, B e C podem ser, respectivamente:
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
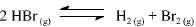
Com base nessas informações, julgue o item que se segue.
Se 0 HBr(g) for colocado em um recipiente fechado, sob
pressão inicial de 0,10 bar, e a temperatura do sistema for
elevada a 500 °C, a pressão parcial de H2(g), quando atingido o
equilíbrio, deve ser maior que 1,0 x 10-7 bar.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
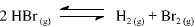
Com base nessas informações, julgue o item que se segue.
A 500 K, a constante de equilíbrio para a reação 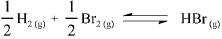 é maior que 1,0 x 104
é maior que 1,0 x 104
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
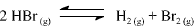
Com base nessas informações, julgue o item que se segue.
Um aumento de temperatura provoca um aumento da
velocidade da reação apresentada.
