Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
A reação 2HI(g) 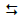 H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
CaCO3(s)
 CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
O deslocamento do equilíbrio no sentido dos produtos é mais favorecido com
Com a finalidade de averiguar os níveis de concentração de cobre e níquel na água de um reservatório que continha uma liga desses metais e que não continha outros metais além desses, um perito recolheu 1 L da água desse reservatório e reduziu esse volume a 100 mL por evaporação. A titulação dessa solução diluída contendo os cátions requereu 55 mL de uma solução de EDTA 0,02 mol/L. Em seguida, excesso de ácido mercaptoacético em meio amoniacal foi adicionado, de maneira a complexar seletiva e quantitativamente os íons Cu2+, liberando quantidade equivalente de EDTA. Essa amostra foi titulada com uma solução de Mg2+ 0,1 mol/L, requerendo 4 mL para o ponto final.
Considerando que, para esse tipo de tanque, os níveis de concentração toleráveis para esses metais sejam de 30 mg/L para cada íon, assinale a opção correta.
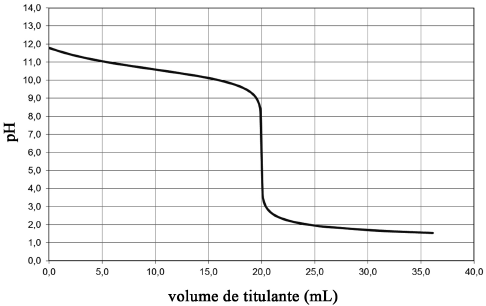
Uma amostra de 50 mL de água recolhida de um aquário contendo
dezenas de peixes mortos foi titulada com ácido clorídrico
0,01 mol/L. A curva do pH × volume de HC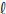 obtida para essa
titulação é mostrada acima. A partir dessas informações
e considerando que, nessa amostra de água, apenas uma das
substâncias — para as quais os valores das constantes de
dissociação ácida (Ka) ou básica (Kb) são fornecidos — está
presente, assinale a opção que indica, corretamente, a substância
titulada.
obtida para essa
titulação é mostrada acima. A partir dessas informações
e considerando que, nessa amostra de água, apenas uma das
substâncias — para as quais os valores das constantes de
dissociação ácida (Ka) ou básica (Kb) são fornecidos — está
presente, assinale a opção que indica, corretamente, a substância
titulada.
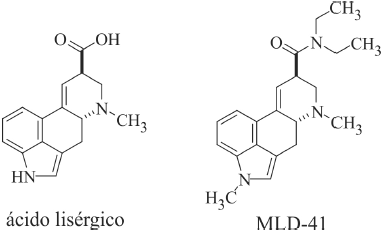
O ácido lisérgico é um alcaloide a partir do qual se originaram
lisergamidas como a MLD-41, substância com propriedades
psicodélicas. Considerando as estruturas químicas mostradas nas
figuras precedentes, bem como as propriedades físicas e químicas
dos grupos funcionais presentes em suas moléculas, assinale
a opção correta.
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com o texto 5A3CCC, na temperatura T0, a constante de
equilíbrio para a reação 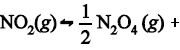 calor será igual a
calor será igual a
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
Texto 5A3BBB
O ácido acético é um ácido fraco cuja constante de ionização ácida (Ka), à temperatura T0, é igual a 1,6 × 10-5 .
Texto 5A3BBB
O ácido acético é um ácido fraco cuja constante de ionização ácida (Ka), à temperatura T0, é igual a 1,6 × 10-5 .
Soluções aquosas dos sais cianeto de sódio (NaCN) e cloreto de
amônio (NH4C ) apresentam pH
) apresentam pH
