Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.163 questões
Considerando a reação de formação do trióxido de enxofre no equilíbrio e sob temperatura e pressão constantes, é correto afirmar que:
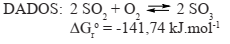
75 mL de uma solução de HCl 0,100 mol L-1 foram misturados com 25 mL de uma solução de NaOH 0,100 mol L-1 . Considerando essas informações, o pH da solução final foi igual a:
Dado: log 5 = 0,70
A amônia pode ser preparada industrialmente pelo processo de Haber-Bosch, representado pela equação não balanceada a seguir.
N2(g) + H2(g) ⇌ NH3(g)
Supondo-se que a 300 ºC, esse experimento apresente concentração de N2 e de H2 de 0,3 e 2,0 mol L-1, respectivamente, e que a constante de equilíbrio Kc seja 10, a concentração de NH3, em mol L-1, nessa temperatura, deve ser, aproximadamente, de
O iodeto de hidrogênio pode ser preparado a partir do hidrogênio e do iodo moleculares na fase gasosa, conforme equação a seguir
H2(g) + I2(g) ⇋ 2HI(g)
Em um dado momento, pode-se determinar o seu quociente de reação (Qc), que representa a razão das concentrações iniciais dos produtos e dos reagentes. Nessa reação, se o valor encontrado de Qc for menor que o valor da
sua constante de equilíbrio (Kc), então,
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Em meio aquoso, um ácido forte apresenta baixa tendência de transferir um próton a uma molécula de água, ou seja, a água apresenta baixa tendência de receber esse próton.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pela definição de Brønsted‐Lowry, um ácido é uma
espécie que tem a tendência de perder ou doar um
próton e uma base é uma espécie que apresenta a
tendência de receber ou adicionar um próton.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pelo princípio de Le Chatelier, uma perturbação em um equilíbrio químico promove um deslocamento no sentido de aumentar a perturbação promovida.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Como a água é um eletrólito forte, sua ionização pode ser representada por: 2 H2O → H3O+ + OH− , sendo a constante de autoprotólise da água escrita por:
KW = [H3O+
]−1 ∙ [OH−]
−1.
Em relação ao equilíbrio químico
2 NO(g)+ 1 O2(g) ↔ 2 NO2(g) + 27 kcal
pode-se afirmar:
Em um recipiente fechado, mantido a uma temperatura de 40°C, são inseridos os gases monóxido de carbono e gás oxigênio, cujas pressões parciais foram determinadas respectivamente em 2,1 e 1,6 atm. Observando a reação química do processo e sabendo-se que no momento que o equilíbrio químico foi atingido a pressão parcial do gás oxigênio era de 0,6 atm, podemos informar que a constante de equilíbrio Kp vale, aproximadamente:
2CO (g) + O2 (g) ↔ 2CO2 (g)
Considere as substâncias a seguir.
A2(g) + 3B2(g)
 2AB3(g)
2AB3(g) Um estudante misturou 50 mL de solução aquosa de ácido sulfúrico 0,10 mol/L com 50 mL de solução aquosa de hidróxido de sódio 0,40 mol/L e introduziu algumas gotas de fenolftaleina. O processo pode ser representado pela equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(aq) + H2O(l)
Ao término da reação, pode-se concluir acertadamente queUm estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq) .Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente