Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
CaCO3(s) ⇌ CaO(s) + CO2(g)
sabendo que cada uma das seguintes misturas (ou uma dada substância) está contida em um recipiente fechado sob determinada temperatura e em repouso.
Dados: Kps AgCl = 1,8x10-10; Kps PbCl2 = 1,7x10- 5 ; √8,5 = 2,9
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
Uma solução-tampão resiste a mudanças de pH quando
um ácido ou uma base são adicionados. Um tampão
ácido estabiliza soluções em pH maior que 7 e um
tampão básico estabiliza soluções em pH menor que 7.
Uma solução que contenha CH3COOH e CH3CO2− é um
típico tampão básico.
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
O equilíbrio químico é o estado em que duas ou mais
fases de uma mesma substância coexistem, sem que
haja tendência à mudança. Pelo princípio de Le
Chatelier, quando uma tensão ocorre nesse sistema em
equilíbrio, ele se ajusta para maximizar o efeito da
tensão, ou seja, quando o sistema em equilíbrio é sujeito
a uma perturbação, tende a aumentar o efeito
perturbador, distanciando-se da condição de equilíbrio.
Sabendo-se que a nova mistura tem constante de equilíbrio igual a 4, após o novo equilíbrio ser alcançado, a quantidade de acetato será de:
Pressurizando o sistema para 10 atm, a composição da mistura muda para:
Com relação ao assunto do texto anterior, julgue o item seguinte.
Durante a titulação do ácido acético com a soda, ocorre a
formação de uma solução tampão.
Com relação ao assunto do texto anterior, julgue o item seguinte.
O ácido acético é um ácido fraco.
CO (g) + CL2 (g) → COCl2 (g)
Sabendo que o grau de equilíbrio é 80%, o cálculo de Kc para esse experimento deverá apresentar o resultado aproximado de
HCI (aq) + KOH (aq) → KCI (aq) + H2O (I)
Após os cálculos, esse pós-graduando concluiu que o pH da solução resultante é igual a:
Dados: αHCl = 100%, Log 5 = 0,7 Massas Molares em g/mol: H = 1; O = 16; Cl = 35,5; K=39,1
Considere a mistura de 100 mL de sulfeto de sódio 0,2 mol L−1 com 100 mL de nitrato de chumbo 0,1 mol L−1 , resultando na formação do precipitado sulfeto de chumbo. A solubilidade, em mol L−1 , do sulfeto de chumbo na solução é de
(Dado: Kps PbS = 3,0x10−28)
(Dado log2 = 0,3)
(Dado: log 8,5 = 0,93)
O íon complexo [Zn(NH3)]+2 é formado a partir 3 4 da seguinte reação química:
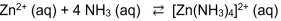
Em um experimento, ao se atingir o equilíbrio químico, as concentrações dos participantes da reação são apresentadas na tabela a seguir.
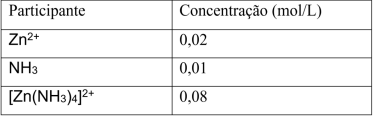
A constante de equilíbrio dessa reação é igual a: