Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
2HF(aq) + C2O42-(aq) ⇆ 2F-(aq) + H2C2O4(aq) Keq
Sabe-se ainda que
(I) HF(aq) ⇆ H+ (aq) + F– (aq) K1
(II) H2C2O4 (aq) ⇆ 2H+ (aq) + C2O4 2– (aq) K2
O valor da constante de equilíbrio Keq pode ser expresso em função das constantes K1 e K2 pela expressão
As velocidades de reação independem do mecanismo da reação, pois independem do número de espécies colidindo. A expressão da constante de equilíbrio depende apenas da estequiometria, que descreve a relação entre as concentrações de reagentes e produtos quando o sistema atinge o estado de equilíbrio químico.
Do ponto de vista cinético, o equilíbrio é um estado de máxima estabilidade para o qual um sistema químico fechado tende a partir de quaisquer outros estados; do ponto de vista termodinâmico, o equilíbrio é um estado dinâmico, em que cada espécie participante da reação se forma exatamente da mesma forma como é consumida.
O equilíbrio químico é um estado em que a velocidade de formação dos reagentes é exatamente igual à velocidade de desaparecimento dos produtos; ou seja, quando uma reação irreversível se processa dos reagentes para os produtos (sentido inverso), tem a mesma taxa de desenvolvimento que a reação que se processa dos produtos para os reagentes (sentido direto).
Indicadores ácido-base são substâncias que apresentam colorações diferentes, a depender da presença de ácidos ou bases no meio em que se encontram; um desses indicadores é a fenolftaleína, substância que apresenta uma coloração rósea (ou violeta) em meios que contêm bases e permanece incolor em meios que contêm ácidos.

Considerando essas informações, assinale a opção correta.

Considere MM (massa molecular) de C = 12 g/mol, O = 16 g/mol, H = 1g/mol e Na = 23 g/mol.

M (molaridade) = mol/L é uma unidade de concentração. Considere pKa = 3,8.
Considere as soluções aquosas a seguir, todas de concentração 0,1 mol/L.
NH4OH (Kb = 1,8 × 10−5)
H3CCOOH (Ka = 1,8 × 10−5)
HF (Ka = 3,5 × 10−4)
HCN (Ka = 4,9 × 10−10)
HCℓO4 (Ka = 2,0 × 107)
O menor pH e a menor condutibilidade elétrica são observados, respectivamente, nas soluções de:
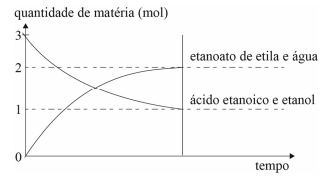
Nesse caso, a constante de equilíbrio da reação em apreço é igual a
A equação seguinte representa a reação de decomposição da água.
H2O (g) ⇌ H2 (g) + 1/2 O2 (g)
Considere que, em um recipiente de 5 L, tenham sido adicionados 225 g de água e, em seguida, esse sistema tenha sido aquecido a 2.000 °C, sob pressão de 1 atm. Assumindo-se que, nesse caso, 70% da água será decomposta e que a massa molar da água (MH20) é igual a 18,0 g/mol, é correto afirmar que a concentração de água remanescente, após a situação de equilíbrio, será de
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.
Com base nesses dados, assinale a alternativa que mostra o valor da constante Kc para essa reação.
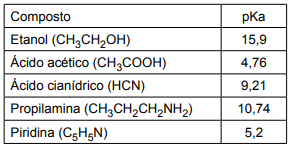
Um técnico propôs preparar cinco soluções aquosas de igual concentração, cada uma contendo um dos seguintes compostos:
- Etóxido de sódio (CH3CH2ONa)
- Acetato de sódio (CH3COONa)
- Cloreto de piridínio (C5H6NCl)
- Ácido cianídrico
- Propilamina
Com base nos dados apresentados, assinale a alternativa que contém os compostos propostos em ordem CRESCENTE do pH das soluções preparadas com eles.
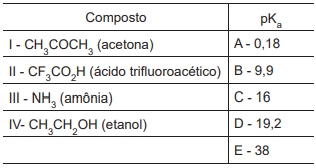
Com base na capacidade de liberar íons H+ em solução, a correta relação entre o composto e seu valor de pKa é:
Dados: Kb(NH3)= 2x10–5
Dados: Log 9,9 = 0,99
HbH+ + O2 →← HbO2 + H+ ∆H < 0
A liberação de gás oxigênio para os tecidos é favorecida pelo(a)