Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
Dentre os indicadores de pH, citam-se:
H2 (g) + Cℓ2 (g) ⇌ 2 HCℓ (g)
Considerando a reação química acima e que, em uma mistura em equilíbrio entre H2 e Cℓ2 para formar HCℓ, as concentrações de H2 e Cℓ2 sejam, respectivamente, 1,00 × 10−11 mol/L e 2,00 × 10−10 mol/L, julgue o item seguinte.
Considerando-se que a constante de equilíbrio Kc da reação
em apreço valha 5,00 × 1018, é correto concluir que a
concentração de HCℓ no equilíbrio será igual a
1 × 10−2 mol/L.
H2 (g) + Cℓ2 (g) ⇌ 2 HCℓ (g)
Considerando a reação química acima e que, em uma mistura em equilíbrio entre H2 e Cℓ2 para formar HCℓ, as concentrações de H2 e Cℓ2 sejam, respectivamente, 1,00 × 10−11 mol/L e 2,00 × 10−10 mol/L, julgue o item seguinte.
Em um equilíbrio químico, quando a constante de equilíbrio
Kc for baixa, o equilíbrio químico estará deslocado para os
produtos, o rendimento da reação será alto e a concentração
dos reagentes será baixa no momento em que o equilíbrio for
atingido.
H2 (g) + Cℓ2 (g) ⇌ 2 HCℓ (g)
Considerando a reação química acima e que, em uma mistura em equilíbrio entre H2 e Cℓ2 para formar HCℓ, as concentrações de H2 e Cℓ2 sejam, respectivamente, 1,00 × 10−11 mol/L e 2,00 × 10−10 mol/L, julgue o item seguinte.
Considerando-se que a formação de HCℓ pela reação em tela
é exotérmica, é correto concluir que a diminuição da
temperatura tenderá a deslocar o equilíbrio da reação no
sentido de formar mais HCℓ.
H2 (g) + Cℓ2 (g) ⇌ 2 HCℓ (g)
Considerando a reação química acima e que, em uma mistura em equilíbrio entre H2 e Cℓ2 para formar HCℓ, as concentrações de H2 e Cℓ2 sejam, respectivamente, 1,00 × 10−11 mol/L e 2,00 × 10−10 mol/L, julgue o item seguinte.
Ao se adicionar Cℓ2 (g) à mistura em equilíbrio, a reação
tenderá a se deslocar no sentido de formação do produto.
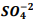 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 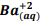 +
+ 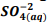 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 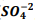 ] = 1, 1 x10−10. Verifica-se que:
] = 1, 1 x10−10. Verifica-se que: I. A partir da concentração de
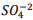 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4. Assinale a alternativa correta:
CH3CO2H(aq) + OH-(aq) ⇔ CH3CO2-(aq) + H2O(l)
Para atingir o ponto de equivalência foram gastos 5,3 x10-6 M de OH- e o pH ficou em 8,72.
Analise as afirmativas a seguir e dê valores Verdadeiro (V) ou Falso (F).
( ) No ponto de equivalência o pH é neutro. ( ) No ponto de equivalência, o pH é ligeiramente básico, porém a partir desse ponto, a adição de mais NaOH torna a solução substancialmente básica.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
A equação que melhor representa a constante de equilíbrio para esse tampão é:
Um par de aminoácido é separado em uma coluna onde a fase estacionária está saturada com água e o solvente transportados é o metanol. Os aminoácidos são:
HOOC-CHNH2-CH2-OH e HOOC-CHNH2-CH3.
Assinale a alternativa que melhor representa o que acontece.
Assinale a alternativa que contenha a concentração no equilíbrio de H2(g), I2(g) e HI respectivamente:
I. Misturando-se as soluções Fe2(SO4)3 e hidróxido de sódio, forma-se um precipitado. II. Misturando as soluções AgNO3 e carbonato de potássio, forma-se um precipitado. III. Misturando as soluções MgCO3 e sulfato de sódio, forma-se um precipitado.
A partir da análise das asserções anteriores, assinale a alternativa correta.
A massa de NaOH (em g) necessária para preparar a solução é:
A fórmula química que representa sua estrutura é apresentada abaixo:
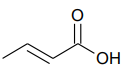
Uma solução aquosa de ácido crotônico foi preparada pela dissolução de 2,15g do ácido em água, sendo o volume final igual a 500mL.
[Dados: massas molares (em g.mol-1). C: 12; H: 1; O: 16.]
O pH dessa solução é igual a
Julgue o item a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
Uma solução 0,5 mol/L de ácido clorídrico (HCl) será
plenamente neutralizada caso reaja com o mesmo volume de
uma solução 0,3 mol/L de hidróxido de bário, sem que haja
excessos.
Julgue o item a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
A densidade de uma solução 0,1 mol/L de cloreto de sódio
é igual à de uma solução mais concentrada desse mesmo
composto.
