Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
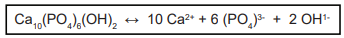
A solução aquosa capaz de evitar a desmineralização dos dentes é:
Nessa temperatura, o valor da constante do produto de solubilidade desse sal é, aproximadamente,
Nessa temperatura, o pKa desse ácido é igual a
Dado log 7 = 0,85
H2 (g) + I2 (g) ⇌ 2 HI (g)
Em um reator, as concentrações iniciais de H2 e I2 foram respectivamente iguais a 3,0 mol L-1 e a 3,5 mol L-1 . Atingido o equilíbrio, a concentração de HI foi de 5 mol L-1 . Nas condições do reator, a constante de equilíbrio da reação em termos de concentrações é igual a
LOD = 3 x (desvio padrão do branco / inclinação da curva de calibração) LOQ = 10 x (desvio padrão do branco / inclinação da curva de calibração)
Considere que um procedimento de validação foi feito para determinar o LOD e o LOQ de um certo método analítico em espectroscopia de absorção atômica. Foram feitas dez medições do branco que, por sua vez, produziram valor médio = 4,24 x 10-3 com desvio padrão = 3,42 x 10-4 . A equação da reta da curva de calibração do método, com os seus respectivos coeficientes angular e linear, foi:
Absorbância = 3,42 x 10-3 conc. (mg L-1 ) + 2,23 x 10-3
O coeficiente de determinação (R2 ) da curva de calibração foi 0,9994. Com base nesses dados, os valores de LOD e de LOQ, em mg L-1 , foram, respectivamente,
H2 N-CH2 -CH2 -CH2 -CH2 -NH2(aq) + 2 H+ (aq) ⇌ +H3 N-CH2 -CH2 -CH2 -CH2 -NH3 + (aq)
Nesse sistema, verifica-se que o(a)
Qual das alternativas a seguir reflete a ordem na qual os compostos AgCl (Kps = 1,8x10−10), Ag2CO3 (Kps = 8,1x10−12) e Ag2CrO4 (Kps = 1,2x10−12) começam a precipitar?
[Ni(NH3)6]SO4; [CoCl2(NH3)4]Cl; K4[Fe(CN)6]; [Mn(CN)6]4-; [Fe(Cl)4]2-; [Co(Cl)3(NH3)3]
(i) Em qual condição o quociente de equilíbrio (Qc) indica se a reação já atingiu o equilíbrio?
(ii) Se Qc < Kc, qual a direção que a reação deve proceder para atingir o equilíbrio?
(iii) Qual o valor de Qc no início de uma reação, isto é, quando nenhum produto ainda foi formado?
Considerando essa reação, assinale a alternativa correta:
(i) um ácido forte for adicionado?
(ii) uma base forte for adicionada?
A figura a seguir apresenta o diagrama de fases da água pura.
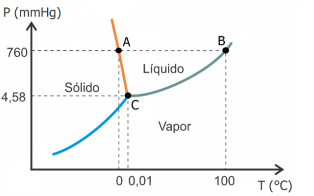
Analise as afirmativas abaixo em relação ao diagrama.
1. O ponto A representa o ponto de ebulição da água a 1,0 atm.
2. Na temperatura de 0,01°C e pressão de 4,58 mmHg, a água na fase sólida sublima.
3. À medida que a pressão aumenta, o ponto de fusão da água aumenta.
4. O ponto B representa o equilíbrio entre as fases líquida e vapor.
5. O ponto C representa o equilíbrio entre a fase sólida e a de vapor.
Assinale a alternativa que indica todas as afirmativas corretas.
1. Uma reação reversível atinge o equilíbrio quando as velocidades das reações direta e inversa se igualam.
2. As propriedades microscópicas do sistema como colisões, formação de complexos e transformações de substâncias permanecem constante, pois o equilíbrio é estático.
3. O equilíbrio químico só pode ser atingido em sistema fechado.
4. A concentração de cada substância do sistema permanece constante no equilíbrio.
Assinale a alternativa que indica todas as afirmativas corretas.
1. Quando alteramos um sistema em equilíbrio, ele buscará adquirir um novo estado que anule essa perturbação.
2. O deslocamento do equilíbrio, ou seja, a busca por uma nova situação de equilíbrio favorecerá um dos sentidos da reação.
3. Se favorecer a reação direta, com formação de mais produto, dizemos que o equilíbrio se deslocou para a esquerda.
4. É dito que se deslocou para a direita, foi favorecida a reação inversa, com formação de reagentes.
5. Existem três fatores que provocam essas alterações de equilíbrio: concentração, pressão e temperatura.
Assinale a alternativa que indica todas as afirmativas corretas.