Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
PbSO4 (s) ⇌ Pb2+(aq) + SO2–4 (aq)
A constante de equilíbrio (Kps) para essa reação é conhecida e equivale a 1,0 × 10−8 . Com base no equilíbrio iônico de solubilidade, a concentração máxima de íons de chumbo (Pb²⁺) na água tratada antes que o PbSO₄ comece a precipitar será de:
No que se refere à modificação de superfícies, julgue o seguinte item.
A engenharia de superfície envolve a alteração das
propriedades da fase a granel para reduzir a degradação do
material ao longo do tempo, o que é conseguido ao se tornar
a superfície maleável ao ambiente em que será usada.
Em uma titulação de neutralização é possível a representação gráfica do ponto final da titulação (pH x
titulante). Em uma titulação de NH4OH com HCl, o gráfico que representa a curva de titulação dessa
reação é
Compostos orgânicos de determinadas funções, e baixo peso molecular, podem ser solúveis em água, ao passo que moléculas dessas mesmas funções orgânicas, de maior peso molecular, tendem a se tornar insolúveis ou apresentam baixa solubilidade. Alterações do pH do meio aquoso podem permitir formações de sais a partir desses compostos maiores, propiciando um aumento de sua solubilidade. Com relação aos compostos I, II e III, assinale a alternativa que contém o meio que aumente sua solubilidade, respectivamente:
Um exemplo clássico de uma reação química em
equilíbrio é a reação entre o monóxido de
nitrogênio (NO) e o dióxido de nitrogênio (NO): 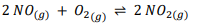
Nesta reação, o monóxido de nitrogênio (NO) reage com o oxigênio (O2) para formar dióxido de nitrogênio (NO2), e também ocorre a reação reversa, na qual o dióxido de nitrogênio (NO2) se decompõe para formar monóxido de nitrogênio (NO) e oxigênio (O2).
Assinale a alternativa que contém a equação para a constante de equilíbrio (KC) para esta reação.
Considerando a equação de equilíbrio a 160 °C
PCl5(g) ←→ PCl3(g) + Cl2(g)
Foi realizado um experimento, à mesma temperatura, e após o equilíbrio determinaram-se as seguintes concentrações:
[PCl5] = 0,027 mol.L-1
[PCl3] = 0,046 mol.L-1
[Cl2] = 0,012 mol.L-1
Desse modo, pode-se dizer que o valor da constante Kc corresponde, aproximadamente, a:
“Em uma solução ácida a concentração de íons hidrogênio (hidrônio) é maior do que a de íons hidróxido”.
Considerando uma solução de HCl de concentração 4,6.10-3 mol.L-1 (log 4,6 = 0,66), a alternativa que indica o pH e o pOH corretamente é:
(RUSSEL, Química Geral, vol. 2, Editora Pearson, 1994)
“Os compostos de coordenação estão presentes na maioria dos processos químicos que envolvem espécies inorgânicas em temperaturas não muito elevadas. Sob o ponto de vista de estabilidade térmica, alguns são estáveis apenas em baixas temperaturas e outros mantêm suas identidades mesmo a altas temperaturas, podendo, até ser volatilizados. Alguns dos que têm elementos de transição como átomo central são paramagnéticos, enquanto os que têm elementos representativos como átomo central são sempre diamagnéticos. Além disso, muitos dos que se formam pelos metais de transição são coloridos; já os formados pelos elementos representativos são brancos, a não ser que se formem com ligantes coloridos”. A alternativa que associa cada composto ao seu nome de forma CORRETA é:
(FARIAS, Química de Coordenação: fundamentos e atualidades, Editora Átomo, 2009)
I - [Ag(NH3)2]+ |
A - Triacetonitrilatriclorocobalto (Ill) |
II - [Co(NH3)6]3+ |
B - Tetracianoplatinato (II) |
III - [Ag(NH3)2]Cl |
C - Hexaminocobalto (III) |
IV - [Co(an)3Cl3] |
D - Cloreto de diaminoprata (I) |
V - [Pt(Cn)4]2- |
E - Diaminoprata (I) |
A reação entre 0,20 mol.L-1 de N2 (g) com 0,20 mol.L-1 de H2 (g) resulta em 0,60 mol.L-1 de NH3 (g) quando atingido o equilíbrio químico. Considerando que a reação química ocorre em condições normais de temperatura e pressão, assinale a alternativa que indica o valor correto da Constante de equilíbrio em função da concentração (Kc) nessas condições.
Considere a equação química não balanceada: N2 (g) + H2 (g) ↔ NH3 (g)
100 mililitros de uma solução de NaOH 0,01mol/l totalmente ionizada apresenta um pH
A concentração do íon hidrogênio [H+] no sangue é mantida dentro de limites estreitos no estado saudável. Em relação às desordens ácido-base, assinale a alternativa correta.
As antocianinas e seus derivados são pigmentos naturais polares da classe de compostos orgânicos chamados flavonoides e estão presentes nas uvas, sendo responsáveis pela cor do vinho tinto. Tais pigmentos são substâncias fenólicas que podem ter diversas cores, como vermelha, roxa, azul, e podem ser encontrados também em pétalas de flores, framboesa, figo, cereja, amora, beterraba, romã, maçã, cebola roxa, repolho roxo entre outros. O extrato aquoso obtido a partir do repolho roxo tem cor roxa e pH 7, a
 , contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH:
, contém antocianinas e pode apresentar o
seguinte comportamento a partir da adição de gotas de
soluções aquosas de substâncias com os seguintes valores
de pH: 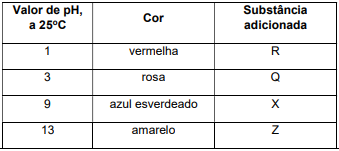
Pode-se verificar então que o extrato aquoso de repolho roxo funciona como um indicador de pH. A solução aquosa da substância R, adicionada a este extrato, pode ser de
Com referência aos conceitos de equilíbrio químico, julgue o item.
Quando um sistema atinge o equilíbrio químico, as reações químicas se cessam.
Com referência aos conceitos de equilíbrio químico, julgue o item.
No equilíbrio químico, a energia potencial do sistema é máxima.
Com referência aos conceitos de equilíbrio químico, julgue o item.
A constante de equilíbrio depende da temperatura.
No cálculo do equilíbrio químico, considera‑se as concentrações dos reagentes divididas pelas concentrações dos produtos.
Dado: Ka (HA) = 2,5.10 − 4 mol.L− 1