Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.163 questões
Necessitando realizar um procedimento experimental durante uma aula de Bioquímica, um analista dissolveu 3,0 g de NH3 (MM= 17g/mol) e 3,0 g de NH4Cl (MM= 53,5 g/mol) em água suficiente para 250 mL de solução. O pH do tampão resultante deve ter valor mais próximo de:
Dado: Ka do NH4 + = 5,6 x 10-10
Solução-tampão é uma solução que contém, geralmente, um ácido fraco com um sal desse ácido, ou uma base fraca com o sal dessa base, com a finalidade de manter o pH de um sistema numa faixa adequada para realização de um experimento. Dentre os pares de espécies químicas abaixo relacionadas, todas serão adequadas para produzir um sistema tampão, EXCETO:
Um tampão foi preparado pela mistura de 0,20 mol de NH4Cl com 0,40 mol de NH3. O pH deste tampão, supondo-se um volume final de um litro, será aproximadamente
Dados: Kb (NH3) = 1,8 x 10-5
Adote log 3,6 = 0,56 ; log 2 = 0,30
A análise de uma bebida carbonatada indicou um pH = 4. Qual a concentração, em mol L-1, de íons H+ nesta bebida?
Análise quantitativa que se realiza para determinar a concentração de uma solução. Permite dosar uma solução e determinar a sua quantidade por intermédio de outra solução de concentração conhecida. Sendo que a solução padrão é a que se conhece a concentração, e a solução problema é aquela da qual procura-se o valor.
A maneira mais fácil de identificar um ácido ou uma base é utilizando um indicador, como por exemplo, o papel de tornassol. Indicador é toda substância que, dependendo do meio em que se encontra, pode mudar de cor. Quando mergulhamos o papel de tornassol em uma solução desconhecida, esse sofrerá alteração em sua coloração. Analise as afirmativas seguintes, relacionadas ao indicador, papel de tornassol e marque a alternativa CORRETA.
I. Se o papel de tornassol ficar vermelho, é sinal de que a substância é neutra.
II. Se o papel de tornassol ficar azul, é sinal de que a substância é básica.
III. Se a cor do papel de tornassol não se alterar, é sinal de que a substância é ácida.
Os indicadores ácido-base são substâncias que mudam sua coloração de acordo com o pH do meio e são utilizadas, dentre outros, em experimentos de titulação. A substância que é incolor em meio ácido e, em meio básico, é rosacarmim (avermelhada) é:
O pH é o parâmetro indicativo do grau de acidez ou alcalinidade do meio. No caso das águas de irrigação, o pH normal está compreendido entre:
A toxidez de alumínio é, provavelmente, 0 fator limitante mais importante para as plantas em solos muito ácidos (pH menor que 5,0 e mesmo pH 5,5 em solos cauliníticos). A toxidez por íons de hidrogênio (H+) pode afetar diretamente o crescimento das plantas em solos com pH menor que 4,2. O pH de um solo é uma expressão da atividade do íon hidrogénio. A principal fonte de hidrogênio, na maioria dos solos com pH menor que 5,5 é a reação do alumínio com a água, como mostrado na equação seguinte:
AI3+ + H2O ------> AI(OH)2+ + H+.
Assim, sobre esse aspecto, julgue os itens a seguir:
I - Essa reação libera H+ (acidificação) que, por outro lado, aumenta a quantidade de AI3+ pronto para reagir novamente.
II - O calcário reduz a acidez do solo (aumenta o PH) convertendo alguns íons de hidrogênio em água.
III - Acima de pH 5,5 0 Al precipita como Al(OH)3 e, assim, sua ação tóxica e a principal fonte de H+ são eliminadas.
Assinale a opção correta:
Um determinado sal X possui solubilidade conforme o gráfico abaixo.
Uma solução saturada de 340g à 50°C foi resfriada até 10°C. Quanto em gramas de soluto precipitará?
Compostos orgânicos de determinadas funções, e baixo peso molecular, podem ser solúveis em água, ao passo que moléculas dessas mesmas funções orgânicas, de maior peso molecular, tendem a se tornar insolúveis ou apresentam baixa solubilidade. Alterações do pH do meio aquoso podem permitir formações de sais a partir desses compostos maiores, propiciando um aumento de sua solubilidade. Com relação aos compostos I, II e III, assinale a alternativa que contém o meio que aumente sua solubilidade, respectivamente:
Uma solução tampão é uma solução que
Assinale a alternativa que indique corretamente a relação entre o pH e a concentração de íons H+ em uma solução.
Água “dura” contém aproximadamente 2.10-3 mol L-1 de íons Ca2+. A adição de íons fluoreto à água de distribuição é uma medida preventiva contra cáries. Sabendo que para CaF₂ o Kps é 4,0.10-11, a concentração máxima de íons fluoreto, que pode ser adicionada à água dura, sem que ocorra formação de precipitados em mol L-1 é, aproximadamente,
Um pesquisador pesou 10,0000 g de CaCO₃, cuja densidade é 2,71 g/cm³, numa balança analítica e transferiu quantitativamente (sem perda de massa) para um recipiente que continha 1,0 L de água, a 25°C. Depois de agitar bem, percebeu visualmente que o sólido solubilizou muito pouco, pois o sólido decantou no fundo do recipiente. De maneira cuidadosa, para evitar perda de massa, ele filtrou o sistema, secou e pesou o material retido no filtro. O valor da massa do material retido no filtro foi 9,9907 g. A solubilidade desse sal, em g/L, é aproximadamente igual a
Em uma indústria produtora de óleo vegetal de soja, situada no Estado da Bahia, um analista, durante o turno A, preparou uma solução de forma errônea, não seguindo o procedimento operacional padrão. Durante o Turno B, um outro analista utilizou a solução preparada no turno A para determinar o Teor de Alcalinidade Combinada presente no óleo da produção, mas os valores foram acima dos aceitáveis para o controle de qualidade de rotina hora a hora. O responsável pela produção dirigiu-se até ao laboratório para entender mais sobre o resultado obtido, antes de modificar algum procedimento na produção. O texto externa algo sobre um erro ocorrido durante a realização de uma técnica muito comum em laboratórios que trabalham com óleos vegetais.
A esse respeito assinale a alternativa correta que corresponde a essa técnica.
Um pesquisador solicitou a um técnico que preparasse soluções de sais de sódio utilizando os ácidos listados na tabela a seguir com uma concentração inicial de 0,500 M.
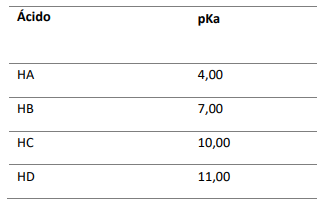
Nessa situação, a solução que terá o pH mais alto e será a mais básica é(são)
Muitas indústrias utilizam caldeiras a vapor, onde ocorrem vários problemas de obstruções devido à qualidade da água. Portanto, um dos parâmetros de controle de qualidade é a dureza da água. Um operador de indústria que processa celulose coletou uma amostra de água da caldeira e enviou ao laboratório de águas para determinação do teor de cálcio em ppm. O analista utilizou 15 mL da amostra de água, 50 mL de Eriocromo T, utilizou um tampão para chegar ao pH 10; na titulação ele gastou 5,9 mL de solução padrão de EDTA 0,02 M.
Assinale a alternativa que apresente corretamente o valor obtido de dureza da amostra de água por meio do teor de cálcio em mg/mL.
A titulação de um ácido forte e uma base fraca pode ser ilustrado pela reação do HCl e NH₄OH, conforme representada abaixo:
HCl + NH₄OH ⇄ NH₄Cl + H₂O
Assinale a alternativa que apresente corretamente o indicador mais apropriado para a titulação.
O produto de solubilidade dos compostos é de grande importância na química analítica, pois, com seu auxílio, é possível não só explicar como também prever as reações de precipitação. Ele também tem importantes aplicações no tratamento de esgoto sanitário, na extração de minerais da água do mar, na formação e perda de ossos e dentes e no ciclo global do carbono.
(ATKINS, P.W.; JONES, L. Princípios de química – Questionando a vida moderna e o meio ambiente, 5ª Edição, 2011.)
A respeito do produto de solubilidade, analise as afirmativas a seguir:
I. A constante do equilíbrio entre um sólido e seus íons dissolvidos é chamada de produto de solubilidade, Kps, do soluto.
II. A constante do produto de solubilidade, Kps para uma solução saturada de Ca(IO3)2 em água é Kps= [Ca+2][IO-3].
III. O produto de solubilidade Kps para o sal de prata AgX é 4,0 x 10-8. A solubilidade molar do AgX em água é 2,0 x 10-4 mol L-1.
IV. A comparação dos valores de Kps não pode ser usada para prever a ordem de precipitação de sais que apresentam a mesma proporção estequiometria entre cátion e ânion.
Está correto apenas o que se afirma em