Questões de Concurso
Sobre equilíbrio químico em química
Foram encontradas 1.218 questões
( ) Reações químicas opostas, simultâneas e com mesma rapidez ocorrem somente se a temperatura variar.
( ) Num sistema em equilíbrio químico em temperatura constante existe uma relação também constante, devidamente calculada, entre as concentrações de reagentes e de produtos.
( ) Uma reação reversível atinge o equilíbrio quando as velocidades das reações direta e inversa se igualam.
( ) A concentração de cada substância do sistema permanece constante ao atingir o estado de equilíbrio.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
CH3COOH(aq) ⇄ CH3COO- (aq) + H+ (aq)
Dado: pH = -log [H+]
Suponha que foi preparada, em laboratório, uma solução aquosa de ácido acético 0,2 mol L-1. O pH dessa solução possui valor aproximado de
Cr2O72- + 14 H+ + 6 Fe2+ → 2 Cr3+ + 6 Fe3+ + 7 H2O
50,00mL de amostra, livre de interferentes, foi tratada com 25,00mL de solução de K2Cr2O7 com concentração igual a 0,04167mol.L-1 , além de H2SO4 e Ag2SO4. A titulação do excesso de dicromato na amostra consumiu 12,50mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 . A titulação do branco consumiu 25,00mL de solução de sulfato ferroso amoniacal 0,2500mol.L-1 .
Dado: Massa molar de O2 = 32,00 g.mol-1 .
A DQO da amostra, expressa em mgO2 L-1 , é igual a
Como as soluções de hidróxido de sódio e ácido clorídrico foram destinadas apenas para correção de pH e, portanto, não precisam ser padronizadas, é adequado prepará-las pesando-se os reagentes comerciais correspondentes em balança semianalítica.
Para ser utilizado na aferição do pH das soluções, o ph-metro deve ser calibrado com, pelo menos, um padrão de calibração comercial, de preferência na região de pH alvo da solução a ser aferida.
Situação hipotética: Um minério contendo magnetita (Fe3O4) foi analisado pela dissolução de uma amostra em HCl concentrado, o que resultou em uma mistura de Fe2+ e Fe3+. Depois de adicionado HNO3 para oxidar o Fe2+ a Fe3+, a solução resultante foi diluída com água e todo o Fe3+ foi precipitado como Fe(OH)3 pela adição de NH4OH. Após filtragem e enxágue, o resíduo foi calcinado, resultando em Fe2O3 puro. Assertiva: Nesse caso, a massa de Fe3O4 presente na amostra é corretamente calculada multiplicando-se por 2/3 a massa de Fe2O3 obtida ao final do processo.
Situação hipotética: Dois ácidos monopróticos, um forte e um fraco, têm a mesma concentração e o mesmo volume inicial e foram titulados com uma mesma solução de NaOH. O gráfico a seguir mostra as curvas de titulação desses dois ácidos monopróticos.
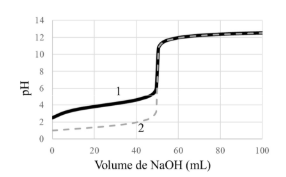
Assertiva: No gráfico, a curva 1 representa a titulação do ácido fraco.
Na titulação de um ácido monoprótico cuja constante de dissociação ácida seja Ka = 1 × 10−4, o indicador ácido-base escolhido terá o melhor rendimento se tiver pKa = 4.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
Segundo Arrhenius, o ácido bórico forma uma solução eletrolítica porque é capaz de se ionizar na presença de água, formando íons livres em solução.
MS(s) → M+2 + S–2 H2S → H+ + HS– HS– → H+ + S–2
Assinale a alternativa que apresenta corretamente a expressão que relaciona a solubilidade (s) do composto MS com o pH da solução.
Considere o seguinte equilíbrio e assinale a alternativa INCORRETA.
2SO2(g) + O2 (g) ⇆ 2SO3(g) ΔH<0
( ) A análise gravimétrica é um método analítico em que são utilizadas somente medições de massa e informações sobre estequiometria de reação para determinar a quantidade de um analito em uma amostra.
( ) Um precipitado deve apresentar as seguintes características no produto final: ter composição conhecida e constante, não ser higroscópico, ser formado de partículas pequenas, ser muito puro e pouco solúvel.
( ) Precipitados são formados por dois processos: por nucleação e por crescimento de partículas.
( ) A filtração é a separação da fase sólida contendo o precipitado desejado da solução-mãe utilizando papel de filtro combinado com funil de vidro, ou, mais comumente, cadinhos filtrantes de vidro sinterizado.
( ) A peptização é um processo no qual os compostos normalmente solúveis são removidos da solução por um precipitado.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Um frasco contém uma mistura em equilíbrio de X2(g) e X atômico, segundo a reação:
X2(g) ⇌ 2 X(g)
A pressão de equilíbrio encontrada foi de 2,4 atm em certa condição de temperatura e volume. Se X2 gasoso a
uma pressão parcial de 3 atm for adicionado à mistura em equilíbrio acima, a volume e temperatura constantes,
a nova pressão de equilíbrio será de 5,66 atm, sendo que, no processo, a pressão do X (g) atômico aumenta
65% em relação ao valor da condição inicial. Nestas condições, assinale a opção que mostra O VALOR MAIS
PRÓXIMO DE Kp para a decomposição de X2(g), na mesma temperatura: