Questões de Concurso
Sobre equipamentos e técnicas básicas em química
Foram encontradas 1.446 questões
A imagem a seguir representa um microscópio óptico e seus componentes.
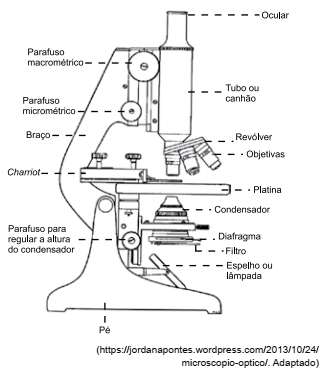
Para ampliar a imagem do objeto observado nesse
microscópio, invertendo-a, e para realizar o ajuste fino
do foco da imagem do objeto observado, são utilizados,
respectivamente, os componentes
“Coloque a quantidade adequada necessária aproximada de amostra nos pesa-filtros individuais e aqueça-os pelo tempo adequado ao tipo de amostra. Quando o aquecimento estiver terminado, tampe os pesa-filtros rapidamente e deixe-os esfriar em um dessecador. Pese um dos pesa-filtros após abri-lo momentaneamente para compensar a variação da pressão. Esvazie rapidamente o conteúdo no frasco que vai receber a amostra, tampe imediatamente e pese novamente o pesa-filtro. Repita o procedimento para cada amostra e determine a massa necessária por diferença.”
(Skoog et al. Fundamentos de Química Analítica. São Paulo: Pioneira Thomson Learning, 2006. Adaptado)
Essa descrição retrata a determinação, em balança analítica, de massa de
O esquema a seguir representa os princípios gerais da técnica de eletroforese capilar.
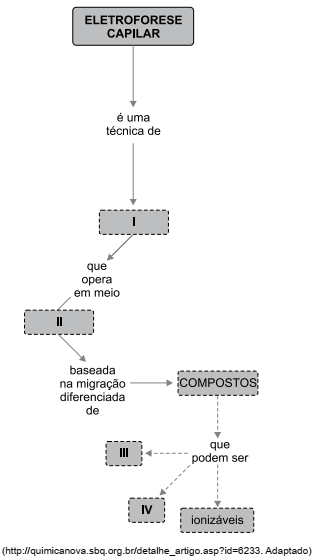
Assinale a alternativa que completa, correta e respectivamente, os quadros I, II, III e IV.
Considere as informações a seguir para responder à questão.
Na verificação qualitativa de íons iodato, IO-3 , foi realizado o teste com íons iodeto em meio ácido, segundo a equação não balanceada:
IO-3 (aq) + I-(aq) + H+(aq) → I2(s) + H2O(ℓ)
Para identificar a formação do I2 (s), toma-se uma alíquota da amostra após a reação, adiciona-se clorofórmio e agita-se. Ao final, se o iodo estiver presente, é observada coloração violeta rosada na fase orgânica.
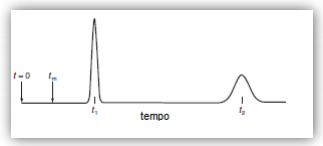
Na determinação dos praguicidas A e B em uma amostra, utilizou-se um sistema de cromatografia líquida de alta-eficiência (CLAE). Esse sistema é composto por uma coluna de fase reversa de 0,46 mm x 15 cm, eluída a 1,0 mL/min a 400 C com a utilização de acetonitrila 35% v/v, sendo a absorbância no UV medida a 254 nm. O cromatograma obtido está apresentado ao lado.
Considerando que a resolução foi de 7,2; o tempo de retenção relativa (α) foi de 3,8; o fator de capacidade (k’) para o composto B foi de 3,5 e o tempo morto (tm) foi de 1,2 min, os valores de t1, t2, e wmédio, são, respectivamente,
A figura abaixo representa o cromatograma de uma mistura contendo as substâncias A, B e C. Os tempos de eluição dessas substâncias são 15 min, 40 mim e 60 min, respectivamente.
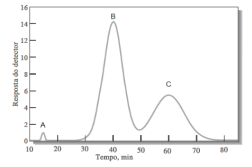
Com base nessa figura, a opção que apresenta a retenção relativa entre as substâncias C e B
e o pico correspondente ao metanol é
A espectrometria de absorção atômica é o método mais utilizado para a determinação de elementos individuais em diversos tipos de amostras. Com relação aos atomizadores, considere as afirmativas abaixo.
I Em um atomizador por chama, uma amostra sólida é nebulizada por um fluxo de oxidante gasoso, misturado com um combustível também gasoso e levado à chama, onde ocorre a atomização.
II Para atingir a máxima sensibilidade analítica, a chama necessita ser ajustada, movendo-a para cima e para baixo em relação ao feixe de radiação até que a região de absorbância máxima seja localizada.
III Nos atomizadores eletrotérmicos, alguns poucos microlitros de amostra são inseridos em um tubo de grafite eletricamente aquecido para que ocorra a secagem, a pirólise, a atomização seguida da limpeza e uma rampa de resfriamento.
IV Na maioria dos métodos baseados em atomizadores eletrotérmicos, as amostras são introduzidas na forma de soluções, não sendo possível fazer a análise direta de sólidos.
Das afirmativas, estão corretas
Dentre os diversos métodos de calibração utilizados nas determinações analíticas , o método do padrão interno, quando empregado adequadamente, pode compensar diversos tipos de erros, quer sejam estes aleatórios ou sistemáticos. Tendo como base esse método de calibração, considere as afirmativas abaixo.
I Um padrão interno é uma substância que é adicionada em quantidade constante na amostra, no branco e nos padrões de calibração de uma análise.
II Para escolha do padrão interno, este deve apresentar propriedades físicas e químicas diferentes do analito.
III Se o padrão interno não for tomado como um constituinte principal na amostra, es te não deve estar presente na matriz da amostra, de forma que a única fonte desse padrão seja a quantidade adicionada.
IV Se, durante as etapas de preparação da amostra, que antecedem à análise, ocorrer uma perda de amostra, o uso de padrão interno não é recomendado.
Das afirmativas, estão corretas
Considere a figura abaixo que apresenta a curva de calibração obtida para a determinação de DQO pela técnica de espectrofotometria utilizando dicromato de potássio em meio ácido, bem como a equação da reta.
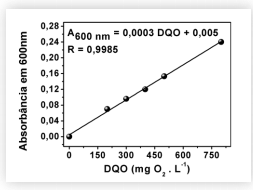
Em uma indústria de processamento de castanha de caju, coletou-se uma amostra de
efluente de 100,0 mL para análise de DQO. Após o tratamento apropriado da amostra com
dicromato de potássio em meio ácido, mediu-se a sua absorbância em 600 nm e obteve-se
um valor de 0,138. Nessa amostra, o valor de DQO em mg O2 L
-1
é
Na Central Analítica do Instituto de Química da UFRN, o técnico de laboratório tem, à disposição, diversos reagentes, utensílios e equipamentos de laboratório. Baseado no princípio das técnicas instrumentais, considere os analitos e as respectivas técnicas de análise abaixo.
I NaCl em soro fisiológico por fotometria de chama e acetona em removedor de esmalte por espectrofotometria UV-VIS.
II NaF em pasta de dente por potenciometria e CaCO3 em comprimido anti-ácido por espectrometria de absorção atômica.
III NaCl em soro fisiológico por espectrofotometria UV-VIS e acetona em removedor de esmalte por espectrometria de absorção atômica.
IV NaF em pasta de dente por cromatografia gasosa e CaCO3 em comprimido anti-ácido por potenciometria.
Os itens que contêm a correlação correta entre os analitos e as respectivas técnicas são
Foram preparados cinco padrões de fosfato dissolvido (P-PO4 3-) e uma prova em branco. Suas absorbâncias foram lidas utilizando uma cubeta com trajeto óptico (TO) de 10 mm, num espectrofotômetro na faixa da luz visível, sendo apresentadas no quadro abaixo (curva de calibração). Ao analisar uma amostra de água, obteve-se uma absorbância de 0,028.
Utilizando as fórmulas abaixo, os valores de a (intersecção da curva de calibração dos eixos x e y), B (declividade da curva de calibração) e a concentração em µM de P-PO43-, na amostra de água analisada, são, respectivamente: Curva de calibração

Em que:
x= concentração dos padrões
y= absorbância dos padrões
N= Número de padrões mais a prova em branco