Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 964 questões
Durante um procedimento de preparação de soluções no laboratório de alimentos, o analista precisa pesar a massa necessária para preparar as soluções abaixo descritas: (Dados: H=1; Na=23; C=12; O=16).
I - 500 mL de uma solução de concentração 0,02 N de carbonato de sódio (Na2CO3), que será utilizada para a padronização de soluções;
II - 1 litro de solução de ácido acético (C2H4O2) 0,025 M, que será usada para a titulação
de soluções.
As massas que devem ser pesadas para a preparação das soluções I e II, respectivamente ,
são:
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
Na determinação do teor de acidez de uma amostra de suco de laranja comercial, 10,00 mL de amostra foram levados para erlenmeyer. Adicionou-se água destilada até completar cerca de 50 mL, 3 gotas de fenolftaleína e titulou-se contra solução padrão de NaOH até mudança de coloração. Na titulação, foram gastos 3,90 mL de solução padrão 0,100 mol.L-1.
A acidez é expressa em termos do teor (porcentagem massa/volume) de ácido cítrico, cuja fórmula estrutural é apresentada a seguir.
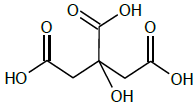
Assinale a opção que expressa a acidez da amostra.
Dados. Massa molar. Ácido Cítrico: 192 g.mol-1.
 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233